
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Селективность ионитов. Теория Грегора
Ионообменный процесс - это всегда равновесный процесс. Переход ионита из одной формы в другую зависит от селективности противоинов и их концентрации.
Как правило, при удалении ионов из разбавленных растворов движущей силой процесса ионного обмена является селективность ионов. Т.е. ионы с большей селективностью вытесняют противоионы с меньшей селективностью, которые находятся в ионите занимая их место. При этом ионы с меньшей селективностью переходят в раствор. Когда в ионите находятся противоионы с большей селективностью, а в растворе ионы с меньшей селективностью, то процесс ионного обмена не будет протекать. Это касается разбавленных растворов.
При использовании концентрированных растворов электролитов противоионы с меньшей селективностью могут вытеснять из ионита противоионы с большей селективностью, в том случае, когда концентрация противоионов с меньшей селективность будет значительно большей в сравнении с концентрацией более селективных противоинов. Здесь движущей силой есть избыточная концентрация или тенденция к выравниванию концентраций. Эту особенность ионного обмена используют при регенерации ионита, т.е. при восстановлении емкости ионита. Восстановление емкости ионита означает переведение его в форму способную к сорбции определенных ионов. При переведении ионита в Н+ - форму он может сорбировать из раствора Na+, K+, NH3+, Ca2+, Mg2+ и др. Таким образом, в процессе сорбции движущей силой является селективность ионита по определенным ионам, а в процессе регенерации - тенденция к выравниванию концентрации и концентрационный напор.
Селективность ионов в значительной мере зависит от их заряда.
Как правило, лучше сорбируются ионы с высшим зарядом вследствие еще более сильного электростатического притягивания. В ряде однозарядных ионов (с одинаковым зарядом), лучше сорбируются ионы с большим радиусом (меньшим радиусом гидратной оболочки).
Считается, что менее гидратированные ионы легче переходят из водной среды в другую фазу (на твердую поверхность). Более гидратированные ионы легче переходят в водный раствор.
Определенные представления об особенностях ионного обмена может дать теория Грегора, основанная на теории мембранного равновесия. Теория мембранного равновесия (осмотическая теория) приписывает иониту определенное избыточное давление, которое называется давлением набухания – π, которое возникает при погружении ионита в воду. Источником этого давления является упругость полимерных цепей матрицы ионита. Введение понятия избыточного давления в фазе ионита или давления набухания дало возможность построить модель ионообменной системы, автором которой является Грегор.
Согласно этой модели изменение объема ионита при изменении состава противоинов является источником избирательности обмена.
Другими словами, давление набухания противодействует сорбции сильно гидратированных ионов. Чем большая гидратация ионов тем большее противодействие силы набухания.
Главное уравнение теории Грегора имеет вид:

К – условная константа ионообменного равновесия;
π - давление набухания;
V1, V2 – объемы гидратированных ионов соответственно с зарядами Z1
и Z2;
φ1, φ2 – коэффициент активности ионов в ионите.
Метод расчета главного параметра этого уравнения (π) основывается на постулате, что активность воды в ионитах аналогичного строения, но разной сетчатости однозначно зависит от содержимого воды. Единственная причина того, что содержание воды в сетчатом ионите меньше чем в ионите с „эффективной нулевой” сетчастостью состоит в наличии дополнительного давления в первом случае.
Исходя из вышесказанного вывели уравнение для расчета давления набухания. В данном случае:
 ,
,
где V∞ - молярный объем растворителя;
а – активность растворителя, которая равняется относительной влажности ионита с конечной сетчастостью;
а0 – активность растворителя, которая равняется относительной влажности ионита с „эффективной нулевой” сетчастостью.
Таким образом, из теории Грегора вытекает следующее. Селективность ионита по разным ионам зависит от заряда ионита, его гидратации и характеристик ионита. Следует отметить, что теория Грегора лишь частично объясняет селективность ионитов к определенным ионам.
Существуют другие факторы, которые существенно влияют на избирательность ионита и не учтенные в теории Грегора. К таким факторам относят фактор жесткости-мягкости кислот и основ. Если взять кислоты в ряду серная, азотная, уксусная, то жесткость кислот возрастает в сторону серной кислоты. Аналогично, в ряду основ NaOH, Ca(OH)2 и Zn(OH)2 жесткость основ возрастает в сторону гидроксида натрия.
Согласно теории жесткости-мягкости основ и кислот наиболее термодинамически устойчивыми являются соединения между жесткими кислотами и жесткими основами и между мягкими кислотами и мягкими основами. Именно этим можно объяснить, что катионит KБ-4 или Levatin Р-207 имеют значительно большую селективность по ионам Zn2+,Ni2+,Cd2+ в сравнении с ионами Ca2+ и Mg2+.
 | 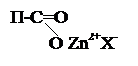 |
+ Zn2+ + Ca2+ + 4X- → + Ca2+ + Na+ + 3X-
Для КУ - 2-8
П – SO3- Na+ + Zn2+ + Ca2+ + 4X- → П SO3- - Ca2+X- + Zn2+ + Na+ + 3X-
Данный подход хорошо объясняет тот факт, что сильно кислотные ионы, в которых функциональными группами являются сульфонатные группы (жесткие кислоты), хорошо регенерируются хлоридами или сульфатами натрия.
П – SO3- Ca+Cl - + nNaCl ↔П SO3-Na+ + CaCl2+ (n-1)NaCl
(П – SO3-) 2Zn2+ +m Na 2SO42+ + 4X- ↔2Г SO4- Na++ZnSO4 +(m-1) Na 2SO42+
При этом катион жесткой основы (Na+), образовывает соль с анионом жесткой кислоты (П – SO3-).
По той же причине реакция слабо кислотных катионов, в которых функциональные группы являются анионами мягких кислот от ионов кальция, цинка, никель, и других, которые являются катионами мягких основ, хлоридом или сульфатом натрия практически не происходит.
(ПC(O)O-)2Ca2++ nNaCl ↔(ПC(O)ONa + CaCl2+ (n-2)NaCl
(ПC(O)O-)2Ni2++mNa2SO4↔2ПC(O)ONa + NiSO4+(m-2)Na2SO4
Лекция 12(ч.2)
Не нашли, что искали? Воспользуйтесь поиском: