
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
БИНАРНЫЕ СОЕДИНЕНИЯ, ИХ НОМЕНКЛАТУРА.
ОКСИДЫ (КЛАССИФИКАЦИЯ)
Состав бинарного соединения можно выразить общей формулой Э'mЭ''n, где атом элемента (Э'') имеет отрицательную степень окисления. Названия бинарных соединений составляются из корня латинского названия электроотрицательного элемента (Э'') с окончанием ''ид'' и русского названия элемента Э' (Э' – элемент с положительной степенью окисления).
Если элемент (Э'), имеющий положительную степень окисления, может находиться в различных степенях окисления, то в скобках римскими цифрами указывается окислительное число (количественное выражение степени окисления).
Примеры бинарных соединений и их названия:
NaH – гидрид натрия, СаН2 – гидрид кальция;
CaF2 –фторид кальция, NaI – иодид натрия;
CrCl3 – хлорид хрома (III), СаС2 – карбид кальция;
Ca3N2 – нитрид кальция, SiC – карбид кремния (IV);
Al4C3 – карбид алюминия, BN – нитрид бора.
К бинарным соединениям относятся оксиды, в составе которых атомы кислорода имеют С.О., равную (-2): Al2+3O3-2, Cr+6O3-2, C+4O2-2.
Названия оксидов составляют аналогично другим бинарным соединениям, например, СаО – оксид кальция, Al2O3 – оксид алюминия, СО2 – оксид углерода (IV), CrO3 – оксид хрома (VI).
 |
При названии оксидов можно указывать греческими числительными (моно, ди, три, тетра) число атомов кислорода, приходящееся на один атом элемента в соединении, например, MnO – монооксид марганца, СО2 – диоксид углерода, СrО3 – триоксид хрома.
По химическим свойствам оксиды делятся на следующие типы:
Основные оксиды – соединения металлов (в низших степенях окисления) с кислородом. Им соответствуют гидроксиды, являющиеся основаниями. Оксиды щелочных и щелочноземельных металлов взаимодействуют (растворяются) с водой с образованием оснований (растворимых в воде – щелочей). Например:Na2O + H2O = 2NaOH; CaO + H2O = Ca(OH)2.
Основные оксиды остальных металлов не растворяются в воде и соответствующие им гидроксиды (основания) получают из солей реакцией обмена со щёлочью. Названия основных гидроксидов определяется названием образующих их металлов:
| Оксид | Соответствующий оксиду гидроксид | |
| Формула | Название | |
| K2O | KOH | Гидроксид калия |
| ВаО | Ва(ОН)2 | Гидроксид бария |
| Al2O3 | Al(OH)3 | Гидроксид алюминия |
| FeO | Fe(OH)2 | Гидроксид железа (II) |
| Cr2O3 | Cr(OH)3 | Гидроксид хрома (III) |
Кислотные оксиды (или ангидриды кислот)- это такие оксиды, которым соответствуют гидроксиды – кислоты. К ним относятся оксиды неметаллов (например, СО2, SO3, P2O2) и оксиды некоторых металлов в их высших степенях окисления (например, CrO3, V2O5, Mn2O7).
Кислотные оксиды можно рассматривать как продукты дегидратации (отщепления воды) кислот (ангидриды). Например:
| Кислота | Ангидрид кислоты |
| H2C+4 O3 | C+4O2 |
| H2S+6O4 | S+6O3 |
| HN+5O3 | N2+5O5 |
| H3P+5O4 | P2+5O5 |
Таким образом, зная формулу кислотного оксида, можно легко вывести формулу соответствующей кислоты и наоборот, зная формулу кислоты, можно написать формулу соответствующего ангидрида.
Амфотерные оксиды – такие оксиды, которые в зависимости от условий проявляют и основные, и кислотные свойства, т.е. могут взаимодействовать как с кислотами, так и с основаниями. К ним относятся оксиды цинка - ZnO, алюминия – Al2O3, хрома (III) – Cr2O3, марганца (IV) – MnO2 и др.
Оксиды основные, кислотные, амфотерные называются солеобразующими. Все они способны образовывать соли при взаимодействии с кислотами или основаниями. Есть небольшая группа оксидов, которые не способны образовывать соли. Они называются несолеобразующими, или индифферентными (NO, CO).
УПРАЖНЕНИЕ 3.
Какие из перечисленных оксидов относятся к основным? К кислотным? К амфотерным? P2O5, CaO, Na2O, Mn2O7, Ni2O3, ZnO, Al2O3, SiO2. Запишите формулы соответствующих им гидроксидов и укажите, какие из них являются основаниями, какие - кислотами, какие проявляют амфотерные свойства. Какие из перечисленных оксидов могут использоваться в качестве осушителей?
ОТВЕТ К основным оксидам относятся оксиды металлов при невысоких степенях окисления. Из приведенных оксидов основными являются: СаО, Na2O, Ni2O3, FeO.
К кислотным относятся: P2O5, Mn2O7, SiO2, т.к. P2O5 и SiO2 – это оксиды неметаллов, а Mn2O7 – оксид марганца в высшей С.О. (+7). Оксиды ZnO и Al2O3 относятся к амфотерным.
Гидроксиды Са(ОН)2, Fe(OH)2, NaOH, Ni(OH)2 – основания; гидроксиды Н3РО4, HMnO4 и H2SiO3 – кислоты; Zn(OH)2 и Al(OH)3 – имеют амфотерный характер.
В качестве осушителей могут использоваться оксиды: Р2О5, СаО, Na2O, т.к. они активно взаимодействуют с водой.
ЗАДАНИЕ 4 (для самоконтроля)
1. Какие основания соответствуют следующим оксидам: Ag2O, MgO, Cu2O, CrO?
2. Каким кислотам соответствуют следующие ангидриды: N2O5, Cl2O7, SO2, CrO3, SiO2?
3. Какие оксиды соответствуют следующим гидроксидам: Cr(OH)3, Zn(OH)2, LiOH, Ba(OH)2?
4. Какие из приведенных оксидов ZnO, FeO, Al2O3, CaO, P2O3, Cr2O3, Mn2O7 обладают амфотерными свойствами?
5. Какие из оксидов: Fe2O3, CaO, MgO, SO3, P2O5, Na2O, CO2, MnO взаимодействуют с водой?
6. Какие оксиды соответствуют следующим кислотам: H2SO3, HNO2, HPO3, H3PO4, H2CrO4?
7. Какие из перечисленных оксидов могут использоваться в качестве осушителей: CaO, SiO2, CuO, P2O5, Fe2O3?
8. Какие из перечисленных выше оксидов (п.7) могут быть использованы для осушки углекислого газа?
9. Каждому основанию соответствует основной оксид – оксид металла. Можно ли утверждать, что всякому оксиду металла соответствует основание? Почему?
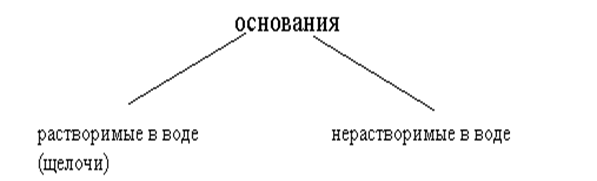 |
§ 5. ОСНОВАНИЯ (КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА)
Растворимые в воде основания – гидроксиды щелочных и щелочно-земельных металлов и аммония. Например, NaOH, KOH, Ca(OH)2, NH4OH. Нерастворимые основания составляют подавляющее большинство. Номенклатуру оснований смотрите в § 4.
Для некоторых основных гидроксидов приняты технические названия: едкий натр (гидроксид натрия) - NaOH, едкий калий (гидроксид калия) - КОН, едкий барий (гидроксид бария) – Ва(ОН)2.
ЗАДАНИЕ 5 (для самоконтроля).
1. Дайте названия следующим гидроксидам: Fe(OH)3, Zn(OH)2, LiOH, Sn(OH)4
2. Запишите формулы отвечающих им оксидов и укажите их характер.
3. Запишите формулы: а) гидроксида Mn (IV); б) дигидроксида олова. Как их можно назвать иначе?
4. Пользуясь таблицей растворимости, укажите, какие из оснований: а) Fe(OH)2, Cu(OH)2, NaOH, Al(OH)3, RbOH; б) LiOH, Co(OH)2, KOH, Ba(OH)2, Ni(OH)2 являются щелочами?
Не нашли, что искали? Воспользуйтесь поиском: