
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Приготування розчину лугу 3 страница
Методичні рекомендації щодо виконання та оформлення:
При виконанні роботи строго дотримуватися кількостей реагентів та методики виконання, вказаної в інструкції, а також правил техніки безпеки.
Зміст і послідовність виконання завдання:
Перекристалізація нітрату натрію
1. Увімкнути електроплитку та нагріти на ній до кипіння 15 мл дистильованої води в маленькому стакані.
2. На технохімічних вагах зважити 25 г натрій нітрату.
3. Другий маленький стакан помістити в великий стакан та налити в великий стакан холодну воду таким чином, щоб вода доходила до середини маленького стакану. В маленький стакан вставити лійку, а в лійку – паперовий фільтр.
4. Зняти стакан з плитки та пересипати наважку в закипілу воду. Розчинити натрій нітрат у воді, перемішуючи скляною паличкою.
5. Добутий розчин швидко відфільтрувати через паперовий фільтр, збираючи фільтрат в охолоджений стакан. Щоб утворилися кристали, фільтрат перемішують скляною паличкою.
6. Виділені кристали знов відфільтрувати через інший паперовий фільтр. Фільтрат можна збирати в перший стакан.
7. Кристали, що залишилися на фільтрі, промити такою кількістю холодної дистильованої води, щоб вона тільки вкрила кристали. Після припинення фільтрування першої порції долити другу порцію води.
8. На електроплитку знов поставити маленький стакан з 15 мл дистильованої води.
9. Фільтр вийняти з лійки, розгорнути і відірвати ту його частину, яка не вкрита кристалами. Потім фільтр з кристалами вмісти в стакан з киплячою водою. Після розчинення кристалів розчин швидко відфільтрувати і піддати кристалізації сіль так само, як і спочатку. Одержані кристали промити на фільтрі.
10. Фільтр з кристалами солі вийняти з лійки і стиснути між двома аркушами фільтру вального паперу для видалення невідфільтрованої рідини. Потім кристали зсипати із фільтра на сухий фільтрувальний папір і висушити за температури 50—60 °С в сушильній шафі, накривши їх фільтром.
11. Пересипати одержану очищену сіль в чисту суху склянку для реактивів.
Після виконання лабораторної роботи студент повинен:
| Знати: Характеристики ступеня чистоти речовин, сутність методу очищення речовин перекристалізацією. | Вміти: Перекристалізувати речовину. |
Захист роботи
- Характеристики ступеня чистоти речовин.
- На яких властивостях речовин ґрунтується метод очищення їх перекристалізацією?
- Проведення перекристалізації.
- Який оптимальний розмір одержаних кристалів та від чого він залежить?
Тестові завдання до РОЗДІЛУ 2
- З точністю до 0,0002 г речовину можна зважити на вагах:
А) технічних;
Б) аналітичних;
В) циферблатних;
Г) аптечних.
- Щоб розрахувати масу наважки речовини, необхідно:
А) до маси порожнього бюкса додати знайдену масу бюкса з речовиною;
Б) помножити масу бюкса на знайдену масу бюкса з речовиною;
В) поділити знайдену масу бюкса з речовиною на масу порожнього бюкса;
Г) від знайденої маси бюкса з речовиною відняти масу порожнього бюкса.
- Наперед приготовані і запаяні в скляних ампулах точно відважені кількості реактиву, необхідні для приготування 1 л 0,1 н. або 0,01 н. розчину, називаються:
А) заготовки;
Б) фіксанали;
В) стандарти;
Г) робочі розчини.
- Швидко приготувати робочий розчин для титрування можна:
А) змішавши необхідні реактиви «на око»;
Б) скориставшись мірним циліндром;
В) з фіксаналу;
Г) взявши наважку речовини на аналітичних вагах.
- Максимальний ступінь чистоти реактивів, якого можна досягти в заводських умовах:
А) «технічний»;
Б) «чистий»;
В) «хімічно чистий»;
Г) «чистий для аналізу».
- Щоб встановити нульову точку на аналітичних вагах, необхідно скористатися ручкою для регулювання нульового положення шкали, на малюнку зображеною під цифрою:

| А) 5; Б) 4; В) 9; Г) 1. |
- Для взяття наважки речовини з метою приготування точного розчину можна скористатися:
А) фільтрувальним папером;
Б) чашкою вагів;
В) безпосередньо мірною колбою;
Г) бюксом.
- Кількість грамів розчиненої речовини, що міститься в 1 мл розчину, називається:
А) молярною концентрацією;
Б) нормальною концентрацією;
В) титром;
Г) масовою часткою.
- При тривалому зберіганні можуть бути неточними в результаті забруднення продуктами взаємодії речовини і скла фіксанали:
А) лугів;
Б) хлоридної кислоти;
В) йоду;
Г) сульфатної кислоти.
- Спосіб очищення речовини, при якому речовину розчиняють в гарячому розчиннику, щоб одержати насичений розчин, потім насичений розчин швидко охолоджують для випадіння кристалів, а кристали, що утворилися, відфільтровують, промивають та висушують, називається:
А) перекристалізація;
Б) постадійне очищення;
В) фільтрування;
Г) гаряче розчинення.
РОЗДІЛ 3
Нагрівання, прокалювання, випарювання, висушування
Нагрівальні прилади поділяють на електричні, газові, рідинні.
Електронагрівальні прилади особливо цінні для лабораторій, де відсутній газ або коли треба нагрівання, а користуватися пальниками не можна (наприклад, перегонка летких органічних розчинників).
| Приклади: електроплити (1), сушильні шафи (2), муфельні печі (3), водяні бані (4), колбо нагрівачі (5), лійки для гарячого фільтрування, нагрівання електролампами (напр, інфрачервоні висушувачі (6)), настінні електричні водонагрівачі, термостати (7), ротаційні випарювачі (8) тощо. |
Вимоги до роботи:
- включати прилад можна тільки в ту мережу, вольтаж якої відповідає вольтажу приладу;
- не гріти прилади без потреби;
- не обливати прилади кислотами, розчинами лугів, солей тощо;
- ставити електронагрівальні прилади не на дерев'яну поверхню столу, а тільки на шар теплоізоляції(азбест, шамот і ін.);
- стежити за чистотою приладів, перед включенням печей переконатися в справності;
- вимикати печі можна, тільки коли ручка реостата знаходиться в нульовому положенні;
- ручку реостата потрібно пересувати не відразу після включення в мережу, а через деякий час, коли піч трохи обігріється, причому збільшувати напруження потрібно поступово.
Електричні плити бувають різного розміру, форми, з відкритим і закритим опором (спіраллю).
Електричні водяні бані зручні для роботи з вогненебезпечними речовинами.
Пісочні бані дають можливість отримати постійну температуру нагрівання, але не більш 400°С. Недоліком є те, що дуже поволі розігрівається пісок.
Повітряні бані працюють до 250°С.
Муфельні печі використовують для прожарювання, плавлення, озолення при 1000-1200°С.
Сушильні шафи використовуються для сушіння при 125°С.
Нагрівання можна проводити безпосередньо відкритим полум'ям і через азбестову сітку. При нагріванні відкритим полум'ям посуд може луснути. При нагріванні через азбест досягається рівномірність обігріву. Але на сітці важко вести нагрівання до певної температури, для цього застосовують різні бані: водяна, парова, сольова, повітряна, пісочна, масляна, гліцеринова, парафінова, з легкоплавких сплавів.
Вимоги до нагрівання:
- при нагріві посуду з скла треба користуватися листами азбесту;
- вогненебезпечні речовини нагрівати на водяній бані;
- стежити за наявністю води у водяній бані;
- масляні бані, які можуть спалахнути, гасять, закриваючи їх листом азбесту.
Прожарювання - нагрівання твердих речовин до високої температури (> 400°С) з метою звільнення від летючих домішок, досягнення постійної маси, проведення реакцій, що протікають при високих температурах, озолення після попереднього спалювання органічних речовин, зневоднення.
Прожарювання проводять в муфельних або тигельних печах, речовина поміщається в тигель.
Вимоги до прожарювання:
- щоб уникнути опіків, не можна брати голіруч нагрітий посуд;
- використовувати тигельні щипці;
- при нагріві або прожарюванні речовин, які можуть розбризкуватися, обов'язково треба надягати захисні окуляри для захисту очей;
- при користуванні приладами, що працюють на рідкому паливі, не можна давати їм перегріватися, резервуар приладу треба періодично охолоджувати,
Випарювання - видалення розчинника шляхом випарювання з метою підвищення концентрації розчину або видалення речовини, що міститься в ньому.
Швидкість випарювання рідини залежить від температури, тиску, площі поверхні випарювання (т.зв. дзеркала), товщини шару рідини, продування над випарюваною поверхнею повітря тощо.
Коли розчинена речовина розкладається при нагріванні, розчинник видаляють під вакуумом або застосовуючи плівкове випаровування.
Випарювання проводять на відкритому повітрі при нормальному (атмосферному) тиску або в закритих апаратах з повною рекуперацією, або уловлюванням, розчинника, що випаровується.
Для випарювання застосовують фарфорові, скляні, емальовані чашки різних діаметрів залежно від кількості випарюваного розчину.
Для випаровування наливають розчин в чашку так, щоб до її країв залишалося не менше 2-3 см, якщо чашка велика; якщо вона малих розмірів, то рідина повинна займати не більше 2/3 висоти чашки. Для випаровування дуже малих кількостей застосовують фарфорові або платинові тиглі.
Розчин залежно від температури кипіння розчин нагрівають на водяній або іншій бані або відкритому вогні (в крайньому випадку).
Невеликі кількості речовин, що легко розбризкуються або виділяють гази, нагрівають в дуже високих, так званих пальцеподібних тиглях. Під час роботи, поки розбризкування або виділення газів ще не кінчилося, такий тигель повинен знаходитися в сильно нахиленому положенні, при цьому частинки речовини не втрачаються, а затримуються на стінках тигля.
Потрібно дотримуватися особливої обережності при випаровуванні горючих розчинників (ефір, спирт, ацетон), водяну баню періодично наповнюють гарячою водою, оскільки використовувати відкрите полум'я не можна.
При випарюванні звичайно не піклуються про уловлювання пари розчинників, тільки при роботі з великими кількостями уловлюють їх.
Коли потрібно піклуватися, щоб у випарювальну чашку не потрапили забруднення з повітря, над чашкою закріплюють спеціальну запобіжну лійку. При випарюванні речовина може «повзти» по стінках чашки і виходити за її краї. Це відбувається при нерівномірному обігріві розчину, коли верхня частина чашки майже не нагрівається. Рекомендується занурювати чашку в баню настільки, щоб рівень налитого в неї розчину не був вищим за рівень рідини в бані.
Коли нагрівання до відносно високої температури може привести до розкладання речовин, випарювання проводять під зменшеним тиском.
В сушильній шафі можна випарювати переважно водні розчини або підсушувати вологі осади, що містять велику кількість води. Органічні вогненебезпечні рідини випаровувати в сушильній шафі не рекомендується, бо можливий вибух (утворення з повітрям вибухонебезпечних сумішей, що вибухають від іскри, невеликого нагріву).
Випарювання органічних вогненебезпечних рідин проводять «безполуменевим способом», використовуючи закриті електроплитки і водяну або іншу бані.
Для випарювання розчинів речовин, властивості яких можуть змінюватися при нагріванні, застосовують плівкові випарювачі із застосуванням вакууму.
Шляхом упарювання підвищують концентрацію розчину.
Висушування в сушильній шафі. Основні осушувачі.
Вміст води в речовинах часто не бажаний, оскільки вона може затримувати перебіг деяких реакцій або викликати ряд побічних реакцій, що заважають основній.
Процес видалення залишків води — зневоднення (а також залишків органічних розчинників) називається висушуванням (в широкому значенні слова).
Розрізняють висушування газів, рідин (в основному органічних), твердих речовин.
В одних випадках вода утворює з речовиною механічну суміш, і велику її частину можна видалити механічним шляхом - віджиманням. В інших випадках вода утворює з речовиною хімічне з'єднання, входячи в нього в певній кількості (кристалізаційна вода). Така вода зв'язується з речовиною з різною міцністю.
Висушування газів проводять наступними способами:
- пропусканням через чисту концентровану сірчану кислоту;
- пропусканням через тверді поглиначі (хлористий кальцій, силікагель);
- виморожуванням.
Сульфатною кислотою сушать гази, з якими вона не реагує. Концентрована 98,3% Н2SО4 має водовіднімаючі властивості.
Для висушування газу пропусканням над твердими речовинами застосовують поглинальні колонки або трубки.
Виморожування засновано на тому, що при пониженні температури знижується і тиск водяної пари, що міститься в газі. Застосовують скляні спіралі, охолоджування за допомогою охолоджувальної суміші, рідким азотом.
Висушування органічних рідин, що містять невелику кількість води, проводять за допомогою прожареного хлористого кальцію. Для зневоднення рідини беруть певну кількість СаCl2 залежно від вмісту в ній води. Багато не беруть, оскільки через це є неминучими втрати речовини, яку зневоднюють.
СаCl2 в потрібній кількості насипають в судину з рідиною, щільно закривають і кілька разів струшують. Залишають на 12 годин. Після цього рідину зливають в колбу для дистиляції і переганяють. СаС12 використовують багато разів після прожарювання. За допомогою СаCl2 не можна сушити спирти і аміни.
Окрім СаС12, використовують Nа2SО4, СuSО4, СаО, Мg(ОС2Н5)2, Nа, СаС2, КОН, К2СОз, А12О3.
Вибрати відповідні для кожного випадку засоби для висушування дуже важливо, оскільки можна зіпсувати всю роботу. Є таблиці для вибору осушувача для зневоднення різних органічних рідин.
Висушування твердих речовин можна проводити на відкритому повітрі при звичайній температури, при підігріві і звичайному атмосферному тиску, при низькій температурі під зменшеним тиском, в атмосфері з малим тиском водяної пари (в ексикаторі), в атмосфері інертного газу.
Висушування при підігріві і звичайному атмосферному тиску проводять в сушильній шафі.
Типи сушильнях шаф:
- мідні або азбестові з газовим або іншим обігрівом;
- мідні сушильні шафи з водяною сорочкою і газовим обігрівом;
- електричні сушильні шафи.
Максимальна температура, до якої можна нагрівати шафу Ш-005 складає 250°С, час розігрівання до неї - 60хв.
Лабораторна робота
Тема: Вмиканнямуфельної печі та установка заданої температури
Мета: навчитися користуватися муфельною піччю.
Обладнання, матеріали: муфельна піч, тиглі, тигельні щипці.
Правила техніки безпеки: дотримуватись правил роботи з електронагрівальними приладами.
Опорні знання:
П р о к а л ю в а н н я - це нагрівання до температури вище 400 ºС для вивільнення речовини від летких домішок, досягнення постійної маси, проведення реакцій при високих температурах, озолення, спалювання. Прокалювання проводять в муфельних печах. Під час роботи муфельної печі температура всередині печі може сягати 900 ºС і вище. Для уникнення виходу з ладу муфельної печі розігрівання її до високих температур проводять поступово, спочатку до середніх температур, а потім – до необхідної високої температури. При роботі з муфельною піччю треба пам’ятати наступні основні правила:
1. Поміщати тиглі для прожарювання в муфельну піч треба до початку її розігрівання.
2. Для уникнення опіків та виникнення пожежі виймати тиглі з муфельної печі після прожарювання можна тільки при зниженні температури всередині печі до 300 ºС.
3. Для розміщення та виймання тиглів необхідно користуватися тигельними щипцями довжиною не менше 40 см.
Методичні рекомендації щодо виконання та оформлення:
При виконанні роботи строго дотримуватися методики виконання, вказаної в інструкції, а також правил техніки безпеки.
Зміст і послідовність виконання завдання:
Вмикання муфельної печі, установка заданої температури
- Перед вмиканням муфельної печі до електромережі перевірити, чи не знаходиться всередині печі сторонній предмет.
- Виставити ручку регулятора температури на мінімум.
- Перевірити цілісність вилки, розетки і електрошнура та увімкнути муфельну піч до електромережі.
- Виставити ручку регулятора температури на необхідну температуру. В разі необхідності установки високих температур спочатку задати проміжну температуру (300-400 ºС).
- Натиснути тумблер на передній панелі муфельної печі.
- Для установки високих температур після досягнення проміжної температури виставити ручку регулятора температури на необхідну високу температуру.
Після виконання лабораторної роботи студент повинен:
| Знати: При яких температурах відбувається прокалювання, з якою метою, як увімкнути муфельну піч та встановити задану температуру, правила техніки безпеки при роботі з муфельною піччю. | Вміти: Увімкнути муфельну піч, встановити задану температуру. |
Захист роботи
- Що таке прокалювання? З якою метою воно застосовується?
- Призначення муфельної печі, межі її робочих температур.
- Вмикання муфельної печі.
- Установка заданої температури, особливості установки високих температур.
- Правила техніки безпеки при роботі з муфельною піччю.
Лабораторна робота
Тема: Випарювання та кристалізація мідного купоросу
Мета: навчитися проводити операції випарювання та кристалізації.
Обладнання, матеріали: стакан, скляна паличка, мірний циліндр, випарювальна чашка, технічні ваги, електроплитка, затискач, пентагідрат купрум(ІІ) сульфату CuSO4∙5 H2O (мідний купорос).
Техніка безпеки: дотримуватись правил роботи з нагрівальними приладами.
Опорні знання:
В и п а р ю в а н н я – процес видалення розчинника або підвищення концентрації розчину. Швидкість випарювання пропорційна площі поверхні розчину та залежить від товщини шару рідини. Тому розчин для випарювання наливають в випарювальну чашку на 2/3 її об’єму.
Якщо речовина розкладається під дією високої температури, випарювання проводять під вакуумом.
Оскільки при випарюванні відбувається підвищення концентрації розчину, то відбувається к р и с т а л і з а ц і я – випадіння розчиненої речовини в осад з насиченого розчину.
Методичні рекомендації щодо виконання та оформлення:
При виконанні роботи строго дотримуватися кількостей реагентів та методики виконання, вказаної в інструкції, а також правил техніки безпеки.
Зміст і послідовність виконання завдання:
Випарювання та кристалізація пентагідрату сульфату купруму
- На технічних вагах взяти наважку CuSO4∙5 H2O 0,5 г у стакан місткістю 100 мл.
- На електроплитці нагріти дистильовану воду у фарфоровому стакані.
- За допомогою мірного циліндру в стакан з наважкою пентагідрату сульфату міді додати 5 мл гарячої дистильованої води. Розчинити, перемішуючи скляною паличкою.
- Розчин перелити у випарювальну чашку, закріпити затискач на чашці та упарювати на електроплитці до повного зникнення води (до одержання кристалів блакитного кольору стійкого кристалогідрату CuSO4∙H2O).
Після виконання лабораторної роботи студент повинен:
| Знати: Що таке випарювання та кристалізація, хімічний посуд для випарювання та кристалізації, правила техніки безпеки. | Вміти: Приготувати насичений розчин, провести його випарювання з одержанням кристалів розчиненої речовини. |
Захист роботи
- Що таке випарювання?
- Обладнання та посуд для випарювання.
- Правила техніки безпеки при випарюванні.
- Що таке кристалізація?
- Що таке насичений розчин?
- Проведення кристалізації, обладнання та посуд для кристалізації.
Лабораторна робота
Тема: Визначення кристалізаційної води в кристалогідраті хлориду барію висушуванням
Мета: засвоїти методику визначення вмісту вологи в кристалічних речовинах.
Обладнання, матеріали: сушильна шафа, ексикатор, щипці, бюкс з кришкою, аналітичні ваги, дигідрат барій хлориду ВаСl2∙2H2O.
Правила техніки безпеки: дотримуватись правил роботи з електронагрівальними приладами, з аналітичними вагами.
Опорні знання:
Вміст кристалізаційної води визначають висушуванням в сушильній шафі точної наважки кристалогідрату до постійної маси, і розраховують за втратою маси наважки. Після висушування треба уникати контакту висушеної речовини з повітрям, тому що повітря містить вологу. Для цього висушену речовину для охолодження поміщають в ексикатор.
В и с у ш у в а н н я – це процес видалення залишків води. Висушування до постійної маси – це декількакратне висушування з наступним охолодженням та зважуванням, яке вважається закінченим, коли маса наважки після останнього висушування не змінилася, або змінилася не більше ніж на 0,0002 г.
Висушування до постійної маси ВаСl2∙2H2O проводять при 125 ºС.
Теоретичний вміст кристалізаційної води в ВаСl2∙2H2O складає 14,75 %.
(Мr (ВаСl2∙2H2O)=137+2∙35,5+2∙18=244; молекулярна маса двох молекул води в ВаСl2∙2H2O складає 36, процентний вміст води в ВаСl2∙2H2O складає 14,75 %)
Методичні рекомендації щодо виконання та оформлення:
При виконанні роботи строго дотримуватися кількостей реагентів та методики виконання, вказаної в інструкції, а також правил техніки безпеки.
Зміст і послідовність виконання завдання:
Висушування ВаСl2∙2H2O до постійної маси, розрахунок вмісту кристалізаційної води
- Добре вимитий бюкс поміщають з встановленою на ребро кришкою в сушильну шафу з температурою 120-125 ºС на 30-40 хв.
- Бюкс з кришкою виймають за допомогою щипців та охолоджують в ексикаторі протягом 20 хв.
- Бюкс з кришкою зважують на аналітичних вагах та записують результат зважування в таблицю 1 в колонку 6.
- Бюкс знов поміщають з встановленою на ребро кришкою в сушильну шафу на 20 хв.
- Бюкс з кришкою виймають за допомогою щипців та охолоджують в ексикаторі протягом 20 хв, знов зважують на аналітичних вагах та записують результат зважування в таблицю 1 в колонку 7. Бюкс вважається висушеним, якщо його маса після другого висушування не змінилася, або змінилася не більше ніж на 0,0002 г.
- У висушений та зважений бюкс помістити 0,5-1 г ВаСl2∙2H2O та зважити, результат зважування записати в таблицю 1 в колонку 1. За різницею мас бюкса з наважкою та порожнього бюкса розрахувати масу наважки та записати її в таблицю 1 в колонку 8.
- Бюкс з наважкою та кришкою, встановленою на ребро, поміщають в сушильну шафу на 2 години.
- Виймають бюкс з кришкою за допомогою щипців з сушильної шафи, закривають кришкою та залишають в ексикаторі для охолодження на 30 хв.
- Бюкс з висушеною наважкою та кришкою зважують на аналітичних вагах та записують результат зважування в таблицю 1 в колонку 2.
- Проводять повторне висушування протягом 30 хв, охолодження та зважування аналогічно п. п. 7-9 до постійної маси бюкса з наважкою. Результати записують в таблицю 1 відповідно в колонки 3-5.
- Розраховують масу кристалізаційної води, що дорівнює різниці мас бюкса з наважкою до висушування та після останнього висушування. Результат записують в таблицю 1 в колонку 9.
- Розраховують вміст кристалізаційної води в % за формулою:
 .
.
Розраховують абсолютну похибку визначення:
D= w – wтеор.
Розраховують відносну похибку:
Dr= 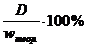 .
.
Таблиця 1 - Результати визначення кристалізаційної води в дигідраті хлориду барію.
| Маса бюкса з наважкою, г | Маса бюкса, г | Маса наважки, г | Маса кристалізаційної води, г | Вміст кристалізаційної води, % | |||||
| До висушування | Після 1-го висушування | Після 2-го висушування | Після 3-го висушування | Після 4-го висушування | Після 1-го висушування | Після 2-го висушування | |||
Після виконання лабораторної роботи студент повинен:
| Знати: Що таке висушування, що таке висушування до постійної маси, як проводять визначення вмісту кристалізаційної води в дигідраті хлориду барію. | Вміти: Провести висушування речовини до постійної маси, розрахувати теоретичний вміст кристалізаційної води в кристалогідраті, визначити вміст кристалізаційної води висушуванням, розрахувати абсолютну та відносну похибку. |
Захист роботи
- Що таке висушування? Висушування до постійної маси?
- Як можна визначити вміст кристалізаційної води в кристалогідраті?
- Способи висушування твердих речовин.
- Способи висушування газів.
- Способи висушування рідин.
- Обладнання для проведення висушування.
- Правила техніки безпеки при роботі з сушильною шафою.
Задачі
1. Обчислити відсотковий вміст кристалізаційної води в кристалогідратах:
а) CaSO4∙2 H2O; б) Na2CO3∙10 H2O; в) MgSO4∙7 H2O.
2. 1,5 г кристалогідрату ферум(ІІ) сульфату зневоднили нагріванням і одержали 0,825 г безводної солі. Обчисліть відсотковий вміст кристалізаційної води в молекулі кристалогідрату ферум(ІІ) сульфату та напишіть його формулу.
Не нашли, что искали? Воспользуйтесь поиском:
 1
1
 2
2
 3
3
 4
4
 5
5
 6
6
 7
7
 8
8