
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Загальна характеристика 4 страница
Протаміни широко поширені в природі, особливо їх багато в статевих клітинах риб, ссавців і людини. Протаміни утворюють міцний комплекс із молекулами ДНК і в такий спосіб захищають їх від несприятливих впливів.
Гістони. Білки з низькою молекулярною масою (12000-24000 Да) і різко вираженими основними властивостями. Розчинні в слабких кислотах. Гістони присутні головним чином у ядрах клітин рослин і тварин. Основні їхні функції - структурна і регуляторна. Гістони мають великий позитивний заряд, що дозволяє їм електростатично взаємодіяти з ДНК і стабілізувати її структуру. Регуляторна функція гістонів полягає в їхній здатності блокувати передачу генетичної інформації від ДНК до РНК.
Протеїноїди. Малорозчинні фібрилярні білки опірних тканин (кісток, хрящів, зв'язок, сухожиль, волосся і т.д.). Для них характерний високий вміст сірки. До протеїноїдів відносяться: фиброїн - білок шовку; кератини - білки волосся, рогів, копит; колагени - білки сполучних тканин.
Складні білки
Складні білки можна розглядати як молекулярні комплекси двох речовин. Небілкова частина (простетична група) міцно з'єднується з білком ковалентними або нековалентними зв'язками, тому такі комплекси функціонують як єдине ціле.
Ліпопротеїни. Простетична група в цих білках представлена ліпідами (вільні жирні кислоти, тригліцероли, фосфоліпіди, холестериди). Ліпопротеїни широко поширені в природі. Вони містяться у всіх клітинних мембранах, плазмі крові, мозку, молоці, яйцях і т.п.
Вільні ліпопротеїни (які не входять в біомембрани) виконують транспортну функцію. Завдяки наявності полярних гідрофільних груп вони розчинні у водному середовищі і здатні переносити ліпіди, що надходять у кров, до різних органів і тканин організму.
Фосфопротеїни. У цих білків залишок ортофосфорної кислоти з'єднаний ефірним зв'язком з гідроксильною групою серину або треоніну. До фосфопротеїнів відноситься багато білків, що грають важливу роль у харчуванні зростаючого організму, зокрема, білок молока - казеїноген, яєчного жовтка - вітелін, ікри риб - іхтулін. Значна їхня кількість міститься в мозку. Фосфопротеїни виконують безліч функцій у живих організмах. Приєднання фосфору до білка (фосфорилювання) змінює активність останнього. Фосфорилювання і дефосфорилювання білків регулює їхнє функціонування в клітці.
Глікопротеїни. Простетичні групи глікопротеїнів представлені вуглеводами і їхніми похідними. Вуглеводний компонент надає молекулі білка нові властивості, у тому числі високу специфічність. На відміну від протеїнів для глікопротеїнів характерна термостабільність: вони витримують і низькі і високі температури без зміни фізико-хімічних властивостей. Глікопротеїни погано переварюються протеолітичними ферментами.
Вуглеводвмісні білки знаходяться у всіх організмах. Вони грають важливу біологічну роль: здійснюють такі функції, як транспорт різних речовин, згортання крові, підтримка імунітету (захист організму від бактерій і вірусів) і ін. Представниками глікопротеїнів є муцини, що обумовлюють високу в'язкість слини, що полегшує проходження їжі по стравоходу. Муцини захищають слизову оболонку шлунка і кишечнику від впливу власних ферментів і погано подрібненої їжі.
Хромопротеїни. Це складні білки, у яких небілкову частину представляють різні забарвлені сполуки, відкіля і пішла їхня назва (від грец. chroma - фарба). Серед хромопротеїнів розрізняють гемопротеїни (що містять у якості простетичної групи залізо), порфірини (які містять магній), флавопротеїни (які містять похідні ізоалоксазину). Хромопротеїни виконують ряд унікальних функцій, беручи участь у найважливіших процесах життєдіяльності: фотосинтезі, диханні, транспорті оксигену й оксиду карбогену, окиснювально-відновних реакціях, світлосприйнятті й ін. До простетичних груп хромопротеїнів відносяться порфіринове кільце, флавинові нуклеотиди і т.д. До хромопротеїнів належать хлорофіл, гемоглобін, багато ферментів - каталаза, пероксидаза, дегідрогеназа й ін.
Флавопротеїни. До флавопротеїнів відносяться білки, пофарбовані в жовтий колір. Фарбування залежить від наявності в них у якості простетичної групи флавінаденіннуклеотиду. Флавопротеїни широко поширені і вони відіграють роль ферментів.
Нуклеопротеїни. Білки, зв'язані з нуклеїновими кислотами. Вони входять до складу будь-якої клітини і грають важливу біологічну роль, беручи участь в утворенні структурних клітинних елементів і передачі спадкоємної інформації.
2.7. БІОЛОГІЧНА ЦІННІСТЬ БІЛКІВ
Білки - найважливіші компоненти харчування. Здатність білка виконувати функцію харчування характеризує його біологічну цінність. Ефективність споживання білкових речовин людиною визначається двома основними факторами: збалансованістю вмісту незамінних амінокислот у білку і його засвоюваністю. Якщо не задовольняється потреба в одній з незамінних амінокислот, то обмежується використання інших, і, отже, знижується цінність білка в цілому. Незамінна амінокислота, що знаходиться в білку в мінімальній кількості, називається лімітуючою амінокислотою, тому що вона найбільшою мірою зменшує біологічну цінність даного білка.
Збагачення харчових білкових продуктів відсутніми амінокислотами застосовується в харчуванні людини у виняткових випадках. Однак додавання синтетичних амінокислот до кормів тварин є звичайною справою. Подібним чином в усім світі готують кормові суміші для домашніх птахів, свиней, корів, що дозволяє більш ощадливо витрачати корми. Відомо, що добавки цих амінокислот поліпшують утилізацію білка тваринами приблизно на 20 %.
Звичайно біологічна цінність білка виражається у відносних величинах. Вона являє собою відношення досліджуваного параметра даного білка до подібного ж параметра "ідеального" білка. У якості останнього використовують казеїн молока, білок яєць, суміш м'язових білків, що легко переварюються і містять незамінні амінокислоти в співвідношеннях, близьких до еталонних. Біологічна цінність даного білка в порівнянні з еталонними показує, наскільки він здатний задовольняти потреби організму в амінокислотах. Для оцінки якого-небудь білка або харчового продукту необхідні дані про вміст у ньому окремих амінокислот, тобто його амінокислотний склад.
Частина рослинних білків (бобові) за своїм амінокислотним складом і біологічною цінністю близька до тваринних. Однак білки насіння більшості сортів зернових (рис, овес) дефіцитні за двома, а частіше (пшениця, кукурудза й ін.) за трьома і чотирьма незамінними амінокислотами. Основною лімітуючою амінокислотою білків зернових культур є лізин. Лімітуючі амінокислоти білків зернових різні в насінні різних культур: у пшениці, рисі і житі - треонін, у кукурудзі - триптофан і т.д. Білки бобових культур відрізняються кращою збалансованістю незамінних амінокислот, що містяться в них, у порівнянні з білками злакових.
У тваринних білків дефіцит незамінних амінокислот виражений слабко. Деяким з них (білки молока, м'яса, субпродуктів) властивий недолік сірковмісних амінокислот. У цілому для тваринних білків більш характерний надлишковий в порівнянні з потребами організму вміст ряду незамінних амінокислот.
У харчуванні більшої частини населення земної кулі наявний дефіцит трьох незамінних амінокислот: лізину, триптофану і метіоніну. Різний амінокислотний склад рослинних і тваринних білків дозволяє підвищити їхню біологічну цінність при споживанні необхідної кількості різноманітної білкової їжі. Тільки таке харчування можна назвати повноцінним.
Таблиця 2.2
Вміст білку в основних харчових продуктах
| Продукт | Білок, г/100 г | Продукт | Білок, г/100 г |
| Яловичина | 18,6-20,0 | Гриби сушені | 20,1 |
| Баранина | 15,6-19,8 | Горіх фундук | 16,1 |
| Свинина мясна | 14,3 | Борошно пшеничне | 10,6 |
| Печінка яловичина | 17,9 | Борошно житнє сіяне | 6,9 |
| Куряче мясо | 18,2-21,2 | Крупа манна | 10,3 |
| Яйця курячі | 12,7 | Крупа гречана | 12,3 |
| Ковбаса варена | 12,2 | Крупа рисова | 7,0 |
| Сервелат | 24,0 | Хліб пшеничний | 7,6-8,1 |
| Молоко | 2,8 | Хліб житній | 4,7-7,0 |
| Сир нежтирний | 18,0 | Макарони | 10,4-11,8 |
| Сири (тверді) | 19,0-31,0 | Капуста | 1,8 |
| Масло вершкове | 0,5 | Морква | 1,3 |
| Картопля | 2,0 | Буряк | 1,5 |
| Горох | 20,5 | Яблука | 0,4 |
| Квасоля | 21,0 | Груші | 0,4 |
2.8. БІЛКИ ХАРЧОВОЇ СИРОВИНИ
Білки м'яса
Білки м'язової тканини повноцінні за своїм складом, легко переварюються і засвоюються організмом. Біологічна цінність м'яса залежить не тільки від складу м'язових білків, але і від наявності сполучної тканини і жиру. Більш високий вміст двох останніх компонентів знижує біологічну цінність м'яса. Білки м'язової тканини виконують скорочувальну функцію, а білки сполучної тканини і хрящової - виконують опірну функцію.
Білки м'язів мають фібрилярну (нитковидну) структуру. Вміст білка в м'ясних продуктах коливається від 11 до 22 %.
Головними м'язовими білками є міозин і актин. Вони беруть участь у м'язовому скороченні і розслабленні при участі АТФ.
Крім того в м'язових клітинах міститься міоглобін, що накопичує О2 у м'язах. Він є глобулярним (у виді кульки) хромопротеїном. В умовах кисневого голодування О2 відщеплюється від міоглобіну, надходить у мітохондрії м'язових клітин, де відбувається синтез АТФ.
Залізо в міоглобіні 2-х валентне (оксиміоглобін). Яскраво-червоне фарбування м'ясних продуктів залежить від міоглобіну й оксиміоглобіну. При окиснюванні міоглобіну утворюється червоно-коричневий метміоглобін. Він втрачає здатність зв'язувати О2 (залізо 3-х валентне). При тепловому впливі також втрачається здатність зв'язувати О2. При цьому змінюється колір виробів (коричневий).
У м'ясі міститься колаген. Багато його в хрящовій тканині, у шкірі, сухожиллях, хрящах, кістках, роговиці ока.
У колагені міститься багато оксипроліну, оксилізину. За кількістю оксипроліну визначають ступінь розвареності колагену при оцінці якості м'яса.
Близьким за складом до колагену є білок еластин. Він міститься в зв'язках і стінках кровоносних судин. Він багатий такими амінокислотами, як гліцин, аланін, лізин, але бідний проліном. М'ясо, багате сполучною тканиною, залишається твердим після теплової обробки. Засвоюваність колагену і еластину низька.
При тривалій термічній обробці колагену утворюється желатин. Він є неповноцінним білком (у ньому немає багатьох амінокислот).
Білки субпродуктів
Субпродуктами називаються другорядні продукти забою тварин: внутрішні органи, голови, хвости, нижні частини кінцівок, губи, вуха, м'ясна обрізь.
Білки субпродуктів відрізняються від білків м'яса за амінокислотним складом та за вмістом сполучної тканини, за здатністю переварюватися ферментами травного тракту. За складом субпродукти поділяють на три групи.
До першої групи відносяться паренхіматозні органи (печінка, легені, нирки, головний мозок, вим'я, селезінка). Остів цих органів складається з колагену.
До другої групи субпродуктів відносяться серце, язик, діафрагма, шлунок. У їхній склад входить сполучна і м'язова тканини.
До третьої групи відносять голови, ноги, губи, вуха, хвости. Будова цих частин туші наближається до складу м'язової, сполучної і жирової тканини. У зв'язку з цим розрізняють субпродукти: м’ясо-кісткові, м'язові, м’якотні шерстисті (вуха, губи), слизуваті.
Субпродукти містять значну кількість білків, але їхня повноцінність відрізняється. Зокрема, вміст неповноцінних білків у печінці - менш 10 %, у яловичих легенях - до 60 %, у яловичих губах - 75 %.
М'ясна обрізь незначно відрізняється від м'яса. Вміст білка в ній 18,9 % (яловича обрізь), кількість колагену в білках обрізі до 4 %. За амінокислотним складом білки обрізі наближаються до м'яса (але вони містять мало триптофану).
Серце. У ньому багато гемоглобіну, а білковий склад його не відрізняється від м'яса.
Язик. За складом він близький до м'яса.
Головний мозок містить мало білків. В основному це альбуміни, глобуліни, ліпопротеіни, нуклеопротеїни.
Легені відрізняються високим вмістом колагену. У них мало повноцінних білків.
Печінка. Вміст білків від 17 до 19 %. Багато міститься глобулінів і альбумінів, хромопротеїнів і феритину (він є постачальником заліза в організмі). Крім того, у печінці містяться нуклеопротеїни, глікопротеїни, колаген і еластин. Білки печінки добре перетравлюються.
Білки яєць
Яйця широко використовуються як окремий продукт, а також у різних технологічних процесах виготовлення їжі. Більшість властивостей яєць обумовлено унікальними особливостями білків.
Протеїни місться в кожній частині яйця в різному стані. У білку яйця до 50 % протеїнів знаходяться в розчиненому стані, у жовтку 44 % - у виді комплексних сполук з ліпідами.
Для яєчного білка характерна наявність протеїнів. Для жовтка характерні комплекси білків з ліпідами, вуглеводами і фосфором. У жовтку яєць містяться два види білків: ововітелін, оволіветин. Вони є складними білками фосфопротеїнами.
У білку яєць містяться: овоальбумін, овомуцин, овомукоїд, овоглобулін, і інші. Білки яєць мають високу біологічну цінність, тому що містять усі незамінні амінокислоти. Вона підвищується при термічному впливі. У сирому яєчному білку міститься авідин, що зв'язує вітаміноподібну речовину біотин. Він призводить до порушення загального стану організму, крім того з'являється шелушіння шкіри, випадає волосся.
Білки молока
Молоко - полідисперсна система. Молоко і продукти його переробки є цінною сировиною і напівфабрикатами. Їх висока біологічна цінність обумовлена оптимальним вмістом і майже ідеальним співвідношенням білків, ліпідів, вуглеводів, мінеральних солей і вітамінів. Завдяки цьому ці речовини засвоюються організмом людини майже цілком.
Ступінь чистої утилізації молочного білка в організмі людини складає 75 %. Висока біологічна цінність білків молока обумовлена складом і збалансованістю незамінних амінокислот, їх гарною переваримістю і засвоюваністю.
Амінокислотний скор жіночого молока майже 100 %, скор коров'ячого молока складає 95 %. Білки коров'ячого молока багаті лізином і треоніном, лімітуючими амінокислотами є метіонін і цистеїн.
Завдяки колоїдному стану білки молока легко доступні для дії травних ферментів. Висока харчова цінність білків обумовлюється тим, що вони утворюють комплекси з вітамінами, особливо групи В, і мінеральними речовинами.
Молоко містить більш 20 білків. Їх поділяють на дві групи: казеїни і сироваткові білки. Вони відрізняються один від одного за молекулярною масою, співвідношенням амінокислот, особливостями складу і структури. За складом білки молока поділяються на прості і складні. До перших відносять сироваткові білки, а до других - казеїноген.
Вміст казеїну в молоці складає 78-85 % усіх білків молока. Казеїн знаходиться у виді колоїдних часток або міцел (ниток), що складаються з більш дрібних часток (субміцел). Казеїн чутливий до іонів кальцію. У їхній присутності випадає в осад. Казеїн є фосфопротеїном, тому що містить у своєму складі фосфорну кислоту. Він приєднує до себе кальцій, магній, натрій. У складі казеїну міститься 4 фракції, що відрізняються за вмістом амінокислот, фосфорної кислоти, за чутливістю до іонів кальцію і сичугового ферменту. Казеїн у молоці знаходиться у виді кальцій-фосфат-казеїновому комплексу. Він складається з казеїнату кальцію, колоїдного фосфату кальцію, лимонної кислоти, магнію, калію і натрію.
Після осадження казеїну в ізоэлектричній точці виявляються сироваткові білки. До їхнього складу входять b-лактаглобулін, a-лактоальбумін, альбумін сироватки крові, імуноглобуліни і протеозопептидна фракція.
КОНТРОЛЬНІ ПИТАННЯ І ЗАВДАННЯ:
1. Що таке білки і яки їх функції в організмі?
2. Перелічте властивості білків.
3. Яке структурне і функціональне значення гідрофобних, кислих і основних, сульфгідрильних груп в білках?
4. Білки підлягали згорянню, після чого в мінералізаті винайшли залізо. Які білки містять цей елемент?
5. Які класифікації амінокислот Вам відомі?
6. Що таке незамінні амінокислоти і в яких продуктах вони містяться?
7. В суміші амінокислот після гідролізу казеїну за допомогою відповідних реактивів винайдено гідрофільні групи. Які амінокислоти містять їх? Напишіть їх формули.
8. До водного розчину амінокислот доданий універсальний індикатор. Визначена кисла реакція. Яким амінокислотам властиві кислі реакції? Напишіть їх формули.
9. За допомогою відповідних реактивів в розчині білка визначена сірка. Які амінокислоти її містять? Напишіть їх формули.
10. Розкажіть про класифікацію білків.
11. Від чого залежить біологічна цінність білків?
Тести для контролю знань і самопідготовки
1. Що таке білки?
| o | а) білки є високомолекулярними полімерами, що побудовані із АК, зв’язаних пептидними зв’язками |
| o | б) білки це високомолекулярні азотовмісні сполуки, що утворюють колоїдні розчини |
| o | в) білки є поліконденсатами АК |
| o | г) білки - це гетерогенні високомолекулярні сполуки мононуклеотидів |
2. Які елементи входять до складу білків?
| o | а) карбоген, гідроген, оксиген, сірка |
| o | б) карбоген, гідроген, оксиген, фосфор |
| o | в карбоген, гідроген, оксиген, нітроген, сірка, фосфор, залізо |
| o | г) карбоген, оксиген, сірка, фосфор, йод, залізо |
3. Які АК належать до моноамінодикарбонових?
| o | а) Ліз, НО Ліз, Арг, Орн |
| o | б) Глу, Асп |
| o | в) Ала, Вал, Лей, Ілей |
| o | г) Глу, Асп, Ліз, Арг |
4. Які АК є постійною складовою частиною білків?
| o | а) Ала, ГАМК |
| o | б) Цис, Цин, Орн, Цит, Гомоцистеін |
| o | в) Вал, Ала, Сер, Глу |
| o | г) Орн, Карнозин, карнітин, ансерин |
5. Які Ак містять сірку?
| o | а) Сер, Тир, Тре, Цис |
| o | б) Вал, Лей, Іле, Тре |
| o | в) Три, Гіс, Про |
| o | г) Мет, Цис, Цин |
6. Яка АК має таку формулу:

| o | а) Цис |
| o | б) Лей |
| o | в) Орн |
| o | г) Арг |
7. Які АК мають такі формули:

| o | а) Сер, Лей, Мет |
| o | б) Тре, Сер, Гіс |
| o | в) Мет, Тре, Цис |
| o | г) Цис, Мет, Тре |
8. Які групи постійно містяться в АК?
| o | а) аміногрупа, карбоксильна |
| o | б) аміногрупа, гідроксильна |
| o | в) карбоксільна, метильна |
| o | г) аміногрупа, метильна, гідроксильна |
9. Яка Ак є диамінодикарбоновою?
| o | а) Цис |
| o | б) Ала |
| o | в) Мет |
| o | г) Гіс |
10. Які АК мають по дві карбоксильні групи?
| o | а) Про, Сер, Мет |
| o | б) Вал, Ілей, Тре |
| o | в) Арг, Ліз, Вал |
| o | г) Глу, Асп |
11. Яка АК має сульфгідрильну групу?
| o | а) Цис |
| o | б) Гли |
| o | в) Мет |
| o | г) Сер |
12. Які АК не мають аміногрупу і тому називаються імінокислотами?
| o | а) Тир, Фен |
| o | б) НО-Ліз |
| o | в) Три, Арг |
| o | г) Про, НО-Про |
13. Які АК мають основні властивості?
| o | а) Ліз, Арг |
| o | б) Лей, Ілей |
| o | в) Про, НО-Про |
| o | г) Вал, Цин |
14. Які АК мають гідроксильну групу?
| o | а) Фен, Ліз |
| o | б) Мет, Цис |
| o | в) Тре, Сер |
| o | г) Асп, Глу |
15. Якими групами зв’язані АК у пептидному ланцюзі?
| o | а) карбоксильними, гідроксильними та аміногрупами |
| o | б) карбоксильна група однієї АК зв’язана з аміногрупою іншої |
| o | в) сульфгідрильними групами |
| o | г) водневими, ковалентними, електронними та іншими зв’язками |
16. Що таке первинна структура білків?
| o | а) унікальна послідовність АК-залишків у поліпептидному ланцюзі |
| o | б) кількісний склад АК у молекулі білка |
| o | в) розташування поліпептидного ланцюга у просторі |
| o | г) певне чергування внутрішньомолекулярних зв’язків у білках |
17. Що є характерним для вторинної структури білків?
| o | а) взаємне розташування поліпептидних ланцюгів всередині білкової молекули з утворенням спіралей |
| o | б) конформаційні взаємозв’язки пептидних ланцюгів |
| o | в) просторова конфігурація поліпептидного ланцюга в білковій молекулі |
| o | г) просторова спіралевидна конфігурація поліпептидного ланцюга |
18. Що таке третинна структура білків?
| o | а) взаємне розташування активних груп АК у пептидному ланцюзі |
| o | б) просторова упаковка спіралей, тобто вторинних структур у молекул активного білка |
| o | в) активна структура білка, зумовлена водневими зв’язками пептидних ланцюгів |
| o | г) асоціація білкових і небілкових субодиниць у макромолекулах білків |
19. Що таке четвертинна структура білків?
| o | а) об’єднання декількох білкових одиниць і небілкових молекул третинної структури в активні білкові міцели |
| o | б) конформаційні структури білка |
| o | в) розташування вторинних структур у просторі білкової молекули |
| o | г) специфічна конформація, характерна для білків з відносно низькою молекулярною масою |
20. Що означає термін „конформація білка”?
| o | а) це асоціація двох, або більше третинних структур у макромолекулі білка |
| o | б) сума всіх зв’язків у білкових молекулах |
| o | в) просторова біологічна активна архітектоніка білкової молекули, утворена за певних умов середовища |
| o | г) розташування активних груп білка в тримірному просторі за певних значень рН середовища |
21. Для яких білків характерні β-спіральні структури?
| o | а) фібрилярних (колаген, кератин) |
| o | б) глобулярних |
| o | в) багатих про і НО-про |
| o | г) багатих глу та арг |
22. Які білки мають структуру статичного клубка?
| o | а) переважно фібрилярні |
| o | б) переважно глобулярні |
| o | в) скорочувальні |
| o | г) нерозчинні кератини |
23. Що таке денатурація білків?
| o | а) повна втрата білками гідрофобних властивостей і здобуття гідрофільних |
| o | б) повна втрата білками нативних властивостей з подальшим порушенням їх специфічної макроструктури |
| o | в) значне порушення всіх ковалентних зв’язків у білковій молекулі |
| o | г) порушення первинної структури білків за збереженням унікальної укладки поліпептидного ланцюга у просторі |
24. Чому розчинні білки є колоїдними?
| o | а) тому, що розмір білкових часток не перевищує 1 мм (10-9 м) |
| o | б) мають високу молекулярну масу, розмір білкових часток коливається від 0,001 до 0,1 мкм (10-6-10-9 м) |
| o | в) мають низьку в’язкість і високий осмотичний тиск |
| o | г) мають гідрофобні властивості |
25. Що таке діаліз білків?
| o | а) відсутність у білкових часток здатності проникати через напівпроникні мембрани |
| o | б) розщеплення білків на АК |
| o | в) здатність білкових часток проходити через напівпроникні мембрани |
| o | г) переміщення білкових молекул до анода |
26. Полярні позитивно зарядженні амінокислоти
| o | а) Вал, Лей, Іле, Мет, Фен, Три, Про, Ала |
| o | б) Гли, Сер, Цис, Асп, Тре, Глу, Тир |
| o | в) Асп, Глу |
| o | г) Лиз, Арг, Гис |
27. Формула треоніну:

28. Формула гістидину:
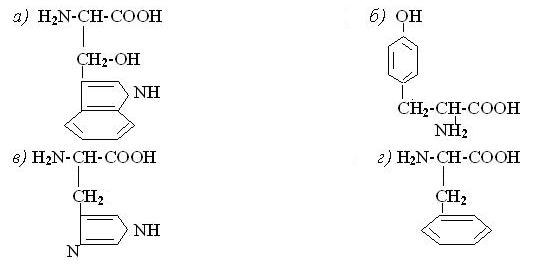
29. Полярні негативно заряджені амінокислоти:
| o | а) Гли, Сер, Тре, Цис, Асп, Глу, Тир |
| o | б) Лиз, Арг, Гис |
| o | в) Вал, Лей, Ізолей, Мет, Фен, Три, Про, Ала |
| o | г) Асп, Глу |
30. Які АК вступають у ксантопротеїнову реакцію?
Не нашли, что искали? Воспользуйтесь поиском: