
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Термодинамические потенциалы системы
Метод термодинамических потенциалов (или метод: характеристических функций) нашел широкое применение в практике анализа равновесных термодинамических систем. Базовым моментом этого метода является использование уравнение сохранения энергии, представленное в виде выражения (П.4.1).
Для объяснения сути метода термодинамических потенциалов обратимся к простой системе, состояние которой определяется выражением (П.4.2). Это выражение связывает между собой пять функций состояния системы: 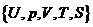 . Отметим, что состояние простой системы (де-факто) определяется двумя параметрами из указанных пяти. Поэтому, выбирая из указанных пяти переменных две в качестве независимых переменных, получаем, что в исходном уравнении (П.4.2) содержится три неизвестные функции. Для их определения необходимо к известному уравнению (П.4.2) добавить еще два уравнения, к которым могут быть отнесены калорическое и термическое уравнения состояния (см. рассмотренный выше пример: «идеальный газ»).
. Отметим, что состояние простой системы (де-факто) определяется двумя параметрами из указанных пяти. Поэтому, выбирая из указанных пяти переменных две в качестве независимых переменных, получаем, что в исходном уравнении (П.4.2) содержится три неизвестные функции. Для их определения необходимо к известному уравнению (П.4.2) добавить еще два уравнения, к которым могут быть отнесены калорическое и термическое уравнения состояния (см. рассмотренный выше пример: «идеальный газ»).
К достоинству метода термодинамических потенциалов следует отнести то обстоятельство, что с его помощью эту задачу (нахождение трех неизвестных) можно решить путем добавления всего одного дополнительного уравнения, а не двух уравнений, как это предполагалось ранее. Ниже будут рассмотрены некоторые возможные варианты установления термодинамических потенциалов равновесных систем.
Вариант №1. Термодинамический потенциал: «внутренняя энергия».
Допустим, что известна функция состояния системы - «внутренняя энергия»:  , где энтропия
, где энтропия  и объем
и объем 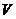 выступают в качестве независимых переменных.
выступают в качестве независимых переменных.
Тогда, используя выражение (П.4.2), представленное в виде
   , ,
| (П.4.11) |
можно с помощью простого дифференцирования определить две оставшиеся переменные (обратить внимание: одна переменная это сама функция -  ):
):
  , , 
| (П.4.12) |
Таким образом, можно считать, что функция внутренней энергии системы  заданная в переменных
заданная в переменных  и
и 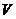 является термодинамическим потенциалом (характеристической функцией) по переменным
является термодинамическим потенциалом (характеристической функцией) по переменным  и
и 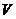 .
.
Следует отметить, что термодинамический потенциал  является не совсем удобным с практической точки зрения, поскольку в нем в качестве независимой переменной фигурирует энтропия
является не совсем удобным с практической точки зрения, поскольку в нем в качестве независимой переменной фигурирует энтропия  , которая недоступна для прямого экспериментального определения.
, которая недоступна для прямого экспериментального определения.
Вариант №2. Термодинамический потенциал: «свободная энергия».
Выберем в качестве независимых переменных простой системы температуру 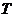 и объем
и объем 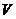 . Отметим, что указанные переменные являются весьма удобными на практике, ввиду доступности их для процедуры измерения.
. Отметим, что указанные переменные являются весьма удобными на практике, ввиду доступности их для процедуры измерения.
Преобразуем выражение (П.4.11) таким образом, чтобы в нем фигурировали дифференциалы  и
и  . Для этого вычтем из обеих частей выражения (П.4.11) дифференциал
. Для этого вычтем из обеих частей выражения (П.4.11) дифференциал  , и после преобразований получим:
, и после преобразований получим:
   . .
| (П.4.13) |
Примем обозначение: 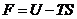 , где
, где 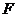 - термодинамический потенциал «свободная энергия». С учетом этой замены имеем:
- термодинамический потенциал «свободная энергия». С учетом этой замены имеем:
   . .
| (П.4.14) |
Согласно выражению (П.4.14) для двух других переменных  и
и  имеем:
имеем:
   , , 
| (П.4.15) |
Таким образом, можно считать, что свободная энергия системы 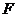 заданная в переменных
заданная в переменных 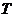 и
и 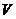 является термодинамическим потенциалом (характеристической функцией) по переменным
является термодинамическим потенциалом (характеристической функцией) по переменным 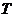 и
и 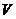 .
.
Термодинамический потенциал  нашел широкое распространение в практике решения задач технологической направленности. В частности, с его помощью можно определить равновесную концентрацию точечных дефектов в кристаллических структурах (см. раздел 1.2.2).
нашел широкое распространение в практике решения задач технологической направленности. В частности, с его помощью можно определить равновесную концентрацию точечных дефектов в кристаллических структурах (см. раздел 1.2.2).
Аналогично рассмотренным вариантам № 1 и 2 можно определить и другие типы термодинамических потенциалов.
Вариант №3. Термодинамический потенциал: «энтальпия».
  
| (П.4.16) | |
   , , 
| (П.4.17) |
Вариант №4. Термодинамический потенциал: «энергия Гиббса».
  
| (П.4.18) | |
   , , 
| (П.4.19) |
Все, рассмотренные выше, термодинамические потенциалы:
· являются аддитивными и однозначными функциями состояния системы;
· позволяют характеризовать реакцию системы при воздействии на нее внешних возмущающих факторов.
Для случая сложных термодинамических систем с переменным числом микрочастиц выражение (П.4.2) трансформируется к виду:
  
| (П.4.20) |
где:  - количество в системе микрочастиц кго типа;
- количество в системе микрочастиц кго типа;  - химический потенциал микрочастиц кго типа.
- химический потенциал микрочастиц кго типа.
Физический смысл выражения (В.4.20) состоит в следующем: изменение внутренней энергии системы  может происходить не только за счет сообщения ей теплоты (
может происходить не только за счет сообщения ей теплоты ( ) от внешнего источника или совершения ею работы (
) от внешнего источника или совершения ею работы ( ) над внешней системой (термостатом), но и - за счет изменения суммарного количества частиц, находящихся в системе
) над внешней системой (термостатом), но и - за счет изменения суммарного количества частиц, находящихся в системе  . Отсюда вытекает физическое содержание параметра «химический потенциал»:
. Отсюда вытекает физическое содержание параметра «химический потенциал»:  - энергия, которая вносится каждой микрочастицей кго типа при ее вхождении в состав термодинамической системы.
- энергия, которая вносится каждой микрочастицей кго типа при ее вхождении в состав термодинамической системы.
Отметим, что в более детальной постановке вопроса, изменение количества микрочастиц в системе  следует представлять в виде:
следует представлять в виде:
   , ,
| (П.4.21) |
где:  - изменение числа микрочастиц в системе, обусловленное процессами обмена с термостатом;
- изменение числа микрочастиц в системе, обусловленное процессами обмена с термостатом;  - изменение числа микрочастиц в системе, обусловленное протеканием в системе различных химических процессов (согласно закону сохранения массы:
- изменение числа микрочастиц в системе, обусловленное протеканием в системе различных химических процессов (согласно закону сохранения массы:  ), где
), где  - масса микрочастицы кго типа).
- масса микрочастицы кго типа).
Учебное издание
Не нашли, что искали? Воспользуйтесь поиском: