
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Атомно-молекулярное учение
Атомно-молекулярное учение создали русский ученый М.В. Ломоносов (1741 г.) и английский ученый Дж. Дальтон (1808 г.).
Атомно-молекулярное учение – это учение о строении вещества, основными положениями которого являются:
1. Все вещества состоят из молекул или атомов. Молекула есть наименьшая частица вещества, которая способна существовать самостоятельно и не может дробится дальше без потери основных химических свойств данного вещества. Химические свойства молекулы определяются её составом и химическим строением.
2. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от агрегатного состояния веществ. С повышением температуры скорость движения молекул увеличивается.
3. Молекулы одного и того же вещества одинаковы, а молекулы различных веществ отличаются массой, размерами, строением и химическими свойствами. Каждое вещество существует до тех пор, пока сохраняются его молекулы. Как только молекулы разрушаются, перестает существовать и данное вещество: возникают новые молекулы, новые вещества. При химических реакциях молекулы одних веществ разрушаются, образуются молекулы других веществ.
4. Молекулы состоят из более мелких частиц – атомов. Атом – это наименьшая частица химического элемента, которую нельзя разложить химическим путем.
Следовательно, атом обуславливает свойства элемента.
Атом – электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов.
Химическим элементом называется вид атомов, характеризующихся определенной совокупностью свойств.
В настоящее время элемент определяется как вид атомов, обладающих одинаковым зарядом ядра.
Вещества, молекулы которых состоят из атомов одного элемента, называются простыми веществами (С, Н2, N2, О3, S8 и т.д.).
Вещества, молекулы которых состоят из атомов двух или более элементов, называются сложными веществами ( H2O, H2SO4, KHCO3 и т.д.). Существенное значение имеет число и взаимное расположение атомов в молекуле.
Способность атомов одного и того же элемента к образованию нескольких простых веществ, называется аллотропией, а образовавшиеся вещества – аллотропными видоизменениями (О2 – кислород, О3 – озон).
Элементы принято обозначать химическими знаками. Следует всегда помнить, что каждый знак химического элемента обозначает:
1. название элемента;
2. один атом его;
3. один моль его атомов;
4. относительную атомную массу элемента;
5. его положение в периодической системе химических элементов
Д.И. Менделеева.
Так, например, знак S показывает, что перед нами:
1. химический элемент сера;
2. один атом его;
3. один моль атомов серы;
4. атомная масса серы равна 32 а. е. м. (атомная единица массы);
5. порядковый номер в периодической системе химических элементов Д.И. Менделеева 16.
Абсолютные массы атомов и молекул ничтожно малы, поэтому для удобства массу атомов и молекул выражают в относительных единицах. В настоящее время за единицу атомных масс принята атомная единица массы (сокращенно а. е. м.), представляющая собой 1/12 часть массы изотопа углерода 12С, 1 а. е. м. составляет 1,66 × 10-27 кг.
Атомной массой элемента называется масса его атома, выраженная в а. е. м.
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы изотопа углерода 12С.
Относительная атомная масса величина безразмерная и обозначается Аr,
например, для водорода 



для кислорода  .
.
Молекулярная масса вещества – это масса молекулы, выраженная в а. е. м. Она равна сумме атомных масс элементов, входящих в состав молекулы данного вещества.
Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы изотопа углерода 12С. Она обозначается Мr. Относительная молекулярная масса равна сумме относительных атомных масс элементов, входящих в молекулу с учетом количества атомов. Например, относительная молекулярная масса ортофосфорной кислоты Н3РО4 равна массе атомов всех элементов, входящих в молекулу:
Мr (Н3РО4) = 1,0079 × 3 + 30,974 × 1 + 15,9994 × 4 = 97, 9953 или ≈ 98
Относительная молекулярная масса показывает, во сколько раз масса молекулы данного вещества больше 1 а. е.м.
Наряду с единицами массы, в химии пользуются также единицей количества вещества, называемой молем (сокращенное обозначение «моль»).
Моль вещества – количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г (0,012 кг) изотопа углерода 12С.
Зная массу одного атома углерода 12С (1,993 × 10-27 кг), можно вычислить число атомов в 0,012 кг углерода:

Число частиц в моле любого вещества одно и то же. Оно равно 6,02 × 1023 и называется постоянной Авогадро или числом Авогадро (NА).
Например, в трёх моль атомов углерода будет содержатся
3 × 6,02 × 1023 = 18,06 × 1023 атомов
Применяя понятие «моль», необходимо в каждом конкретном случае точно указать, какие именно структурные единицы имеются в виду. Например, следует различать моль атомов водорода Н, моль молекул водорода Н2, моль ионов водорода  или
или 
Молярная масса – величина, равная отношению массы вещества к количеству вещества. Она имеет размерность кг/моль или г/моль и обозначает буквой М.
Масса и количество вещества – понятие разные. Масса выражается в кг (г), а количество вещества – в молях. Между массой вещества (m, г), количеством вещества (n, моль) и молярной массой (М, г/моль) существуют соотношения:
n =  , г/моль; М =
, г/моль; М =  , г/моль; m = n x M, г.
, г/моль; m = n x M, г.
По этим формулам легко вычислить массу определенного количества вещества, молярную массу вещества или количества вещества.
Пример 1. Чему равна масса 2 моль атомов железа?
Решение: Атомная масса железа равна 56 а.е.м. (округленно), следовательно, 1 моль атомов железа весит 56 г, а 2 моль атомов железа имеют массу 56 х 2 = 112 г.
Пример 2. Сколько моль гидроксида калия содержится в 560 г КОН?
Решение: Молекулярная масса КОН равна 56 а.е.м. Молярная = 56 г/моль. В 560 г гидроксида калия содержится:  10 моль КОН. Для газообразных веществ существует понятие молярный объём Vm. Согласно закону Авогадро моль любого газа при нормальных условиях (давление 101,325 кПа и температуре 273К) занимает объем 22,4 л. Эта величина называется молярным объемом (его занимают 2 г водорода (Н2), 32 г кислорода (О2) и т.д.
10 моль КОН. Для газообразных веществ существует понятие молярный объём Vm. Согласно закону Авогадро моль любого газа при нормальных условиях (давление 101,325 кПа и температуре 273К) занимает объем 22,4 л. Эта величина называется молярным объемом (его занимают 2 г водорода (Н2), 32 г кислорода (О2) и т.д.
Пример 3. Определить массу 1 л оксида углерода (ΙV) при нормальных условиях (н. у.).
Решение: Молекулярная масса СО2 равна М = 44 а.е.м., следовательно, молярная масса равна 44 г/моль. По закону Авогадро один моль СО2 при н.у. занимает объем 22,4 л. Отсюда масса 1 л СО2 (н. у.) равна  г.
г.
Пример 4. Определить объём, занимаемый 3,4 г сероводорода (Н2S) при нормальных условиях (н.у.).
Решение: Молярная масса сероводорода равна 34 г/моль. Исходя из этого, можно записать: 34 г Н2S при н.у. занимает объем 22,4 л
3,4 г ________________________ Х л,
отсюда Х =  л.
л.
Пример 5. Сколько молекул аммиака содержится:
а) в 1 л б) в 1 г?
Решение: Число Авогадро 6,02 × 1023 указывает на количество молекул в 1 моле (17 г/моль) или в 22,4 л при н.у., следовательно, в 1 л содержится

 .
.
Число молекул аммиака в 1 г находим из пропорции:
17 г содержат 6,02 × 1023 атомов
1 г  х,
х,
отсюда  .
.
Пример 6. Какова масса 1 моль воды?
Решение: Молекулярная масса воды H2O равна 18 а.е.м. (атомная масса водорода – 1, кислорода – 16, итого 1 + 1 + 16 = 18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 6,02 × 1023 молекул воды.
Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
Например, масса 1 моля серной кислоты H2SO4 равна 98 г
(1 +1 + 32 + 16 + 16 + 16 + 16 = 98),
а масса одной молекулы H2SO4 равна  = 16,28 х 10-23 г
= 16,28 х 10-23 г
Таким образом, любое химическое соединение характеризуется массой одного моля или мольной (молярной) массой М, выражаемой в г/моль (М(H2O) = 18 г/моль, а М(H2SO4) = 98 г/моль).
Эквивалент
В настоящее время в химии используются понятия: эквивалент, молярная масса эквивалента или эквивалентная масса (грамм – эквивалент).
Эквивалент – реальная или условная частица вещества, которая в данной реакции эквивалентна атому или иону водорода, т.е. соединяется с одним атомом или ионом водорода либо замещает его. Например: в реакции
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
двум ионам водорода в HCl соответствует одна молекула Ca(OH)2. Следовательно, одному иону водорода эквивалента условная частица, равная половине молекулы Ca(OH)2. Это и будет эквивалент гидроксида кальция в данной реакции: Э(Ca(OH)2) = ½ Ca(OH)2.
Эквивалент – величина безразмерная.
Число ½ для Ca(OH)2) называется фактором эквивалентности и может обозначатся, как 
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества.
Эквивалентная масса (молярная масса эквивалента вещества) mэкв – это масса одного эквивалента данного вещества. Величина mэкв определяется или экспериментально, или, чаще всего, исходя их химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения).
mэкв (оксида) = Моксида ;
 число атомов кислорода, умноженное на степень окисления атома кислорода
число атомов кислорода, умноженное на степень окисления атома кислорода
mэкв (основания) = Моснования;
 кислотность основания
кислотность основания
mэкв (кислоты) = Мкислоты;
 основность кислоты
основность кислоты
 mэкв (соли) = Мсоли.
mэкв (соли) = Мсоли.
число ионов металла, умноженное на заряд иона металла
Нужно помнить, кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты, например:
mэкв (Fe2O3) =  26,7 г/моль;
26,7 г/моль;
mэкв (H2SO4) =  49 г/моль;
49 г/моль;
mэкв (Са(ОН)2) =  37 г/моль;
37 г/моль;
mэкв (Al2(SO4)3) =  171 г/моль.
171 г/моль.
Для эквивалентов, как условных частиц, можно рассчитать молярную массу и количество вещества.
Молярная масса эквивалента вещества – масса одного моля эквивалента, равная произведению фактора эквивалентности на молярную массу этого вещества:
Мэкв = fэкв х М
Величина фактора эквивалентности рассчитывается по следующим формулам:

 1;
1;
fэкв  (кислоты) =
(кислоты) =  число ионов
число ионов  в молекуле кислоты, участвующих в химической реакции
в молекуле кислоты, участвующих в химической реакции

 1;
1;
fэкв  (основания) =
(основания) =  число ионов
число ионов 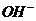 в молекуле основания, участвующих в химической реакции
в молекуле основания, участвующих в химической реакции

 1.
1.
fэкв  (соли) =
(соли) =  число катионов в молекуле соли умноженное на заряд катиона
число катионов в молекуле соли умноженное на заряд катиона
Фактор эквивалентности величина переменная. Её можно рассчитать либо по уравнению реакции, в которой участвует вещество, либо по формуле вещества, например: Н3РО4 может участвовать в следующих взаимодействиях с КОН:
| Уравнение реакции | Фактор эквивалентности Н3РО4 |
| 1) Н3РО4 + КОН → КН2РО4 + Н2О | fэкв  ( ( , ,
|
| 2) Н3РО4 + 2КОН → К2НРО4 + 2Н2О | fэкв  ( ( , ,
|
| 3) Н3РО4 + 3КОН → К3РО4 + 3Н2О | fэкв  ( ( . .
|
Таким образом, при последовательном замещении атомов водорода в молекуле Н3РО4 на катион калия изменяется величина фактора эквивалентности ортофосфорной кислоты. Если уравнение реакции не приводится, то фактор эквивалентности определяют по формуле вещества:
fэкв  (
( .
.
Количество вещества эквивалента (в моль) – отношение массы вещества к молярной массе его эквивалента:
 =
=  .
.
В результате работ И.В. Рихтера (1792 – 1800 гг.) был открыт закон эквивалентов: все вещества взаимодействуют друг с другом в количествах прямо пропорциональных их эквивалентам.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
 или
или 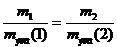 ,
,
где m1 и m2 – массы реагирующих или образующихся веществ;
mэкв(1) и mэкв(2) – эквивалентные массы этих веществ.
Пример: Определите массу карбоната натрия Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение: воспользуемся законом эквивалентов  , определяем эквивалентные массы веществ, исходя из их химических формул:
, определяем эквивалентные массы веществ, исходя из их химических формул:
mэкв(Na2CO3) =  = 53 г/моль; mэкв(H2SO4) =
= 53 г/моль; mэкв(H2SO4) =  = 49 г/моль, тогда
= 49 г/моль, тогда
 , отсюда Х = 2,12 кг.
, отсюда Х = 2,12 кг.
Степень окисления
Понятие – степень окисления введено для характеристики состояния атома в молекуле. При определении этого понятия условно предполагают, что в соединении валентные электроны полностью перешли к более электроотрицательным атомам, а потому соединения состоят только из положительно и отрицательно заряженных ионов. В действительности же при образовании большинства соединений происходит не отдача электронов, а только смещение общей электронной пары в молекуле к более электроотрицательному атому.
Степень окисления – это условный заряд, который приписывается атому, исходя их предположения, что молекула соединения состоит только из ионов, и при этом электронейтральна.
Степень окисления определяется числом частично или полностью смещенных электронов от одного элемента к другому в соединении. В простых веществах отсутствует какое – либо смещение электронов, поэтому степень окисления элементов в простых веществах считается равной нулю, например:  и т.д.
и т.д.
При определении степени окисления атомов в сложных соединениях,
нужно помнить:
1) степень окисления водорода в соединениях со всеми элементами равна (+1), кроме солеобразующих гидридов щелочных и щелочноземельных металлов  и т.д., где степень окисления водорода равна (− 1);
и т.д., где степень окисления водорода равна (− 1);
2) степень окисления кислорода в большинстве соединений равна (− 2), за исключением соединения кислорода с фтором  , в котором степень окисления кислорода (+ 2) – фторид кислорода; пероксидов
, в котором степень окисления кислорода (+ 2) – фторид кислорода; пероксидов  супероксидов
супероксидов 
3) степень окисления фтора во всех сложных соединениях равна (− 1);
4) высшая положительная степеньокисления элементов равна номеру группы периодической системы, в которой находится элемент, например: 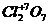 ;
;  ;
;  ;
;  и др. (кроме следующих элементов: Cu; Ag; Au; O; F; He; Ne; Ar; Fe; Co; Ni; Pd; Pt и некоторые другие).
и др. (кроме следующих элементов: Cu; Ag; Au; O; F; He; Ne; Ar; Fe; Co; Ni; Pd; Pt и некоторые другие).
5) низшая отрицательнаястепень окисления элементов характерна только для элементов главных подгрупп IV − VII групп и атома водорода 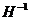 . Низшая отрицательная степень окисления этих элементов рассчитывается по формуле:
. Низшая отрицательная степень окисления этих элементов рассчитывается по формуле:
номер группы, в которой находится элемент, минус 8.
Например, сера находится в шестой группе периодической системы Д.И. Менделеева и низшая степень окисления серы: 6 – 8 = – 2.
6) степень окисления атомов элементов определяют по молекулярной формуле, считая, что алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе – заряду иона.
Примеры: а) Вычислить степень окисления хрома в соединении хромовой кислоте H2CrO4.
Обозначим степень окисления хрома через Х, так как сумма всех степеней окисления в соединении должна быть равной нулю, то умножим известные степени окисления водорода (+ 1) и кислорода (– 2) на число их атомов в соединении, просуммируем степени окисления всех атомов в молекуле, составим уравнение: (+ 1) ∙ 2 + Х · 1 + (– 2) ∙ 4 = 0, отсюда Х = +6.
б) Вычислить степень окисления фосфора в соли ортофосфата натрия Na3PO4.
Обозначим степень окисления фосфора через Х, так как сумма всех степеней окисления в соединении должна быть равной нулю, то умножим степень окисления натрия (+ 1) и кислорода (– 2) на число их атомов в соединении, просуммируем степени окисления всех атомов в молекуле, составим уравнение:
(+ 1) ∙ 3 + Х · 1 + (– 2) ∙ 4 = 0, отсюда Х = +5.
в) Вычислить степень окисления атома серы в ионе  .
.
Обозначим степень окисления атома серы через Х, так как сумма всех степеней окисления в соединении должна быть равной заряду иона, т.е. – 2, то умножим степень окисления кислорода (– 2) на число их атомов в ионе  , просуммируем степени окисления всех атомов в молекуле, составим уравнение:
, просуммируем степени окисления всех атомов в молекуле, составим уравнение:
(Х) · 1 + (– 2) ∙ 4 = – 2, отсюда Х = +6.
Таким образом, чтобы определить степень окисления элемента по формуле иона, нужно степень окисления элемента обозначить через Х. Записать значения степеней окисления атомов всех элементов в формуле иона, просуммировать значения степеней окисления атомов всех элементов, сумму приравнять к величине заряда иона (так как любой ион имеет определенный заряд) и решить уравнение с одним неизвестным.
Задача 1. Определить степень окисления хрома в соединении  .
.
2 ∙ (+1) + 2 ∙ (Х) + 7 ∙ (− 2) = 0,
2Х = 14 − 2,
2Х = + 12,
Х = + 6.
Таким образом, чтобы определить степень окисления элемента по молекулярной формуле, нужно степень окисления элемента обозначить через Х. Записать значения степеней окисления атомов всех элементов в молекулярной формуле, просуммировать значения степеней окисления атомов всех элементов, сумму приравнять к нулю (так как молекула любого вещества электронейтральна) и решить уравнение с одним неизвестным.
Ответ: степень окисления хрома в соединении равна + 6.
Чтобы составить химическую формулу соединения, необходимо знать степени окисления атомов элементов, образующих это соединение. Степень окисления некоторых важнейших элементов приводятся в таблице 1.
Таблица 1 – Степени окисления важнейших элементов
| Степень окисления | Элементы | Примеры формул кислородных соединений |
| Элементы с постоянной степенью окисления | ||
| +1 | Li, Na, K, Rb, Cs, F | Li2O, K2O |
| +2 | O, Be, Mg, Ca, Ba, Zn, Sr | MgO, ZnO |
| +3 | Al | Al2O3 |
| Элементы с переменной степенью окисления | ||
| +1, +2, +3 | Cu | Cu2O, CuО, KCuO2 |
| +2, +3, +6 | Fe | FeO, Fe2O3, K2FeO4 |
| +2, +4, −4 | C, Sn, Pb | CO, CO2, CH4 |
| +3, +5, −3 | P, Sb, N | P2O3, P2O5, PH3 |
| +2, +3, +6 | Cr | CrO, Cr2O3, CrO3 |
| +2, +4, +6, −2 | S, Se | SО, SO2, SO3, H2S |
| +2, +3, +4, +6,+7 | Mn | MnO, Mn2O3, MnO2, MnO3, Mn2O7 |
| +1, +3, +5, +7, −1 | Cl, Br, I | Cl2O, Cl2O3, Cl2O5, Cl2O7, HCl |
| +1, −1 | H | H2O, NaH |
Основное правило, согласно которому составляются формулы соединений, молекулы которых состоят из атомов двух элементов, состоит в том, что произведение степени окисления атомов одного элемента на число атомов этого элемента должно быть равно произведению степени окисления атомов второго элемента на число атомов второго элемента. Согласно этому правилу надо найти наименьшее общее кратное степеней окисления обоих элементов и частное от деления его на степень окисления каждого элемента даст число атомов этих элементов в молекуле.
Например, нужно найти формулу соединения марганца с кислородом, зная, что марганец имеет степень окисления + 7, а кислород – 2. Наименьшее кратное степеней окисления равно 14, делением его на степени окисления элементов получим искомую формулу вещества –  .
.
Подобным же образом поступают при составлении молекулярных формул кислот, оснований, солей.
Не нашли, что искали? Воспользуйтесь поиском: