
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства кислотных оксидов
1) Все растворимые в воде кислотные оксиды взаимодействуют с водой с образованием кислородных кислот, например:
CO2 + H2O → H2CO3,
CrO3 + H2O → H2CrO4,
P2O5 + H2O → 2H3PO4,
SO3 + H2O → H2SO4,


 SiO2 + H2O
SiO2 + H2O
2) Кислотные оксиды взаимодействуют с основными и амфотерными оксидами, например:
а) с основными оксидами: P2O5 + Na2O → 2NaPO3,
SO3 + K2O  K2SO4,
K2SO4,
SiO2 + CaO  CaSiO3,
CaSiO3,
SO3 + BaO → BaSO4.
б) с амфотерными оксидами: 3SO3 + Al2O3 → Al2(SO4)3,
SiO2 + ZnO → ZnSiO3.
3) Все кислотные оксиды взаимодействуют с сильными основаниями, например: CO2 + NaOH → NaHCO3,
CO2 + 2NaOH → Na2CO3 + H2O,
SO3 + NaOH → NaHSO4,
SO3 + 2NaOH → Na2SO4 + H2O,
P2O5 + 6KOH → 2K3PO4 + 3H2O.
При взаимодействии кислотного оксида с основанием возможно образование различных типов солей (средних, кислых, и основных), например:
CO2 + Ca(OH)2 → CaCO3 + H2O,
2CO2 + Ca(OH)2 → Ca(HCO3)2,
CO2 + 2Ca(OH)2 → (CaOH)2CO3 + H2O.
Кислотные оксиды раньше называли ангидридами кислот, например:
CO2 – ангидрид угольной кислоты;
P2O5 – ангидрид фосфорной кислоты.
4) Взаимодействие с простыми веществами (металлами и неметаллами), например: CO2 + 2Mg  C + 2MgO,
C + 2MgO,
Р2О3 + О2 → Р2О5.
Амфотерные оксиды
Амфотерными оксидами называют оксиды металлов, которые в зависимости от условий проявляют свойства кислотных и основных оксидов, т.е. обладают двойственными свойствами. Металлы в амфотерных оксидах находятся в промежуточных степенях окисления между высшей и низшей, чаще всего + 2, + 3, + 4, например: 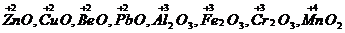 и т.д.
и т.д.
Амфотерные оксиды могут быть получены следующими способами:
1 способ: Окисление простого вещества – металла, например:
2Zn + O2 → 2ZnO.
2 способ: Термическое разложение амфотерных гидроксидов, например:
2Al(OH)3  Al2O3 + 3H2O.
Al2O3 + 3H2O.
3 способ: Термическое разложение некоторых солей, например:
(NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O,
N2↑ + Cr2O3 + 4H2O,
ZnCO3  ZnO + CO2.
ZnO + CO2.
Не нашли, что искали? Воспользуйтесь поиском: