
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства оснований
1) Водные растворы щелочей изменяют окраску индикаторов (таблица 4).
Таблица 4 – Окраска индикаторов в растворах щелочей
| Индикатор | Цвет индикатора | Цвет индикатора в растворе щелочи (рН > 7) |
| лакмус | фиолетовый | синий |
| фенолфталеин | бесцветный | малиновый |
| метилоранж | оранжевый | желтый |
2) При растворении в воде основания диссоциируют.
Сильные однокислотные основания диссоциируют в водных растворах полностью (на 100%) на катионы металла и анионы – гидроксогруппы 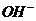 , например:
, например: 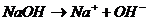 ,
,  .
.
Слабые основания в водных растворах диссоциируют незначительно. Процесс диссоциации слабых электролитов обратим. При этом устанавливается химическое равновесие между молекулами слабого основания и ионами, на которые идет диссоциация, например:  .
.
Многокислотные основания в водных растворах диссоциируют по ступеням с постепенным отщеплением аниона – гидроксогруппы 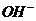 .
.
Таким образом, сколько анионов – гидроксогруппы 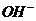 содержится в молекуле основания, столько будет ступеней диссоциации у этого основания.
содержится в молекуле основания, столько будет ступеней диссоциации у этого основания.
Нужно помнить, что многокислотные сильные основания по первой ступени диссоциируют необратимо, а слабые основания по всем ступеням диссоциируют обратимо, например:
1 ступень 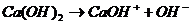 , ,
| 1 ступень  , ,
|
2 ступень  . .
| 2 ступень  . .
|
Ступенчатой диссоциацией многокислотных оснований объясняется образование основных солей.
3) Все основания (растворимые и труднорастворимые) взаимодействуют с кислотами (как сильными, так и слабыми) с образованием соли и воды.
Реакция между кислотой и основанием называется реакцией нейтрализации, например:
KOH + HCl → KCl + H2O,
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O,
2NaOH + H2S → Na2S + 2H2O.
4) Щелочи взаимодействуют с кислотными и амфотерными оксидами, например: Ca(OH)2 + CO2 → CaCO3↓ + H2O,
2KOH + CO2 → K2CO3 + H2O,
KOH + CO2 → KНCO3,
2NaOH + ZnO  Na2ZnO2 + H2O↑.
Na2ZnO2 + H2O↑.
5) Растворимые в воде сильные основания взаимодействуют с некоторыми неметаллическими и металлическими простыми веществами (галогенами, фосфором, кремнием, алюминием и т.д.), например:
2KOH + Cl2 → KCl + KClO + H2O,
2KOH + 2Аl + 6H2O → 2К[Аl(ОН)4] + 3Н2.
6) Растворы щелочей взаимодействуют с растворами солей, если в результате образуются труднорастворимые основания, амфотерный гидроксид или труднорастворимая соль, например:
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4,
2KOH + MgCl2 → Mg(OH)2↓ + 2KCl,
Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH.
7) Труднорастворимые в воде основания разлагаются при нагревании на основной оксид и воду, например:
2CuOH  Сu2O + H2O,
Сu2O + H2O,
Fe(OH)2  FeO + H2O.
FeO + H2O.
Основания щелочных металлов при нагревании не разлагаются, например: NaOH – не разлагается.
8) Растворимые в воде основания реагируют с амфотерными гидроксидами, реакции между твёрдыми веществами, например:
KOH + Al(OH)3  KAlO2 + 2H2O↑,
KAlO2 + 2H2O↑,
реакции в растворах, например: KOH + Al(OH)3 → К[Al(OH)4],
3KOH + Al(OH)3 → К3[Al(OH)6].
Не нашли, что искали? Воспользуйтесь поиском: