
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства средних солей
1. Диссоциация средних солей.
Нужно помнить, что средние соли диссоциируют необратимо по типу сильного электролита, в одну ступень с образованием всех ионов, входящих в состав соли, например:
Al2(SO4)3 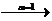 2Al3+ + 3SO
2Al3+ + 3SO 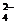 ,
,
K3PO4 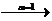 3K+ + PO
3K+ + PO 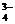 ,
,
Cu(NO3)2  Cu2+ + 2NO
Cu2+ + 2NO  ,
,
CH3COONH4  CH3COO- + NH
CH3COO- + NH  .
.
2. Соли взаимодействуют с металлами с образованием новой соли и нового металла. Данный металл может вытеснять из раствора соли только те металлы, которые находятся правее его в электрохимическом ряду напряжений, где М(1) более активный металл, чем М(2). Например: реакция взаимодействия раствора сульфата меди (II) с металлическим железом идет с выделением металлической меди: CuSO4 + Fe → FeSO4 + Cu.
Железо вытесняет медь из раствора соли меди, потому что железо – более активный металл, чем медь (смотри ряд напряжений (активности) металлов).
3. Растворы солей взаимодействуют со щелочами с образованием новой соли и нового труднорастворимого основания или труднорастворимой соли, например:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl,
CuSO4 +NaOH → Cu(OH)2↓ + NaSO4,
K2CO3 + Ba(OH)2 → BaCO3↓ + 2KOH.
Реакции могут протекать с образованием основных солей, например:
FeCl3 + KOH → Fe(OH)Cl2 + KCl,
FeCl3 + 2KOH → Fe(OH)2Cl + 2KCl.
4. Соли взаимодействуют с кислотами с образованием новой более слабой кислоты (смотрите ряд активности кислот) или новой труднорастворимой соли, например: BaCl2 + H2SO4 → BaSO4↓ + 2HCl,
 CO2
CO2

 Na2CO3 + 2HCl → 2NaCl + H2CO3
Na2CO3 + 2HCl → 2NaCl + H2CO3
H2O.
5. Соли взаимодействуют между собой с образованием новых солей, если одна из солей выпадает в осадок, например:
AgNO3 + KCl → AgCl↓ + KNO3.
6. Некоторые соли разлагаются при нагревании, например:
MgCO3  MgO + CO2↑,
MgO + CO2↑,
(NH4)2Cr2O7  N2↑ + Cr2O3 + 4H2O,
N2↑ + Cr2O3 + 4H2O,
KNO3  KNO2 + O2↑.
KNO2 + O2↑.
Кислые соли
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на ионы металла.





 Например: KHCO3 – гидрокарбонат калия, NaHSO4 – гидросульфат натрия и т.д. В кислых солях, кроме ионов металла и кислотного остатка содержаться ионы водорода (H+)
Например: KHCO3 – гидрокарбонат калия, NaHSO4 – гидросульфат натрия и т.д. В кислых солях, кроме ионов металла и кислотного остатка содержаться ионы водорода (H+)







 Н О О неполное замещение атомов водорода Na O O
Н О О неполное замещение атомов водорода Na O O




 S S
S S

 H O O атомами металла H O O
H O O атомами металла H O O
кислота (двухосновная) NaHSO4 – кислая соль
Двухосновная кислота с любым металлом образует одну нормальную и одну кислую соль.
Трёхосновная кислота с любым металлом образует одну нормальную и две кислые соли:
|
 I
I
 | |||
 | |||
 | |||
замещение 

|


 1 атома
1 атома  I
I
водорода

 H – O
H – O

 H – O – P = O
H – O – P = O
|




 замещение
замещение 
 II
II
2 атомов
водорода 
Не нашли, что искали? Воспользуйтесь поиском: