
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Заповнення підрівнів по періодах періодичної системи
| Періоди | Малі | Великі | |||||
| I | II | III | IV | V | VI | VII | |
| Підрівні, що заповнюють- ся (валентна оболонка) | 1 s | 2 s 2 p | 3 s 3 p | 4 s 3 d 4 p | 5 s 4 d 5 p | 6 s 4 f 5 d 6 p | 7 s 5 f 6 d |
Запам'ятайте перевірений вами порядок. Кожен період починається з заповнення s- підрівня зовнішнього електронного рівня, а завершується заповненням його p -підрівня. Виключення складає лише перший період, у якому заповнюється тільки підрівень 1 s.
Орбіталі того самого підрівня, що мають під час відсутності зовнішніх електричних і магнітних полів однакову енергію, заповнюються у відповідності з правилом Хунда. За цим правилом сумарний спін електронів має бути максимальним. Це означає, що орбіталі підрівня заповнюються електронами спочатку по одному і при однаковій орієнтації спінів.
Приклад 3. Розподіліть по орбіталях d- підрівня 3, 5, 6, 8 і 10 електронів.
Розв’язання. Якщо виходити тільки з принципу Паулі, можливі наступні конфігурації при розподілі трьох електронів по п'ятьох орбіталях (d 3) :
Σ ms





Однак, за правилом Хунда реалізується лише одне - останнє з зазначених розподілів. Конфігурації  і
і  вважаються еквівалентними, якщо в просторі не виділені якісь особливі напрямки (наприклад, напрямок зовнішнього електромагнітного поля).
вважаються еквівалентними, якщо в просторі не виділені якісь особливі напрямки (наприклад, напрямок зовнішнього електромагнітного поля).
Зрозумівши правило Хунда, легко знайти і всі інші розподіли:

d6 

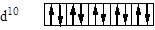
Електронні структури атомів відображають за допомогою графічних схем або електронних формул. В останньому випадку записують позначення підрівнів, а у верхньому індексі – число електронів на орбіталях цих підрівнів. Наприклад, Li – 1 s 22 s 1, C – 1 s 22 s 22 p 2, Ne - 1 s 22 s 22 p 6, Cl – 1 s 22 s 22 p 63 s 23 p 5. Для елементів з великим порядковим номером такий повний запис виявляється занадто громіздким. Тому звичайно користуються короткими електронними формулами. Вони тим більше зручні, що відображають конфігурацію тільки валентної оболонки. Валентна оболонка містить у собі електрони валентних орбіталей, що приймають участь в утворенні хімічного зв'язку. Сюди входять s - і p -підрівні зовнішнього рівня, а також d -підрівень попереднього рівня. У кожнім періоді заповнюється одна валентна оболонка.
Якщо ви добре пам¢ятаєте порядок заповнення підрівнів по періодах (табл.3), короткі формули можна записати враховуючи, що загальне число електронів на валентній оболонці дорівнює номеру елемента від початку періоду. Таке число електронів необхідно послідовно розподілити по орбіталях підрівней, що заповнюються у даному періоді. Не забувайте при цьому про максимальну ємність підрівнів!
Наприклад, для атомів елементів V періоду: Rb – 5 s 1 (перший елемент у періоді), Y – 5 s 24 d 1 (третій елемент з початку періода), Nb – 5 s 24 d 3 (п’ятий), Cd –5 s 24 d 10 (дванадцятий), Sn – 5 s 24 d 105 p 2 (чотирнадцятий) або 5 s 25 р 2 (цілком заповнений d- підрівень можна не записувати, якщо за ним йде частково заповнений), Xe - 5 s 24 d 105 р 6 (вісімнадцятий і останній у періоді) або 5 s 25 р 6.
Іноді в електронних формулах завершені внутрішні рівні позначають їхніми літерними символами або символами атомів інертних газів, що завершують передостанній період. Їх оболонки органічно входять до структури атомів елементів наступних періодів. Зокрема, для ванадію замість повної електронної формули V - 1 s 22 s 22 p 63 s 23 p 64 s 23 d 3 можна написати KL3 s 23 p 64 s 23 d 3 або [Ar]4 s 23 d 3.
У залежності від того, який підрівень останнім заповнюється електронами, всі елементи поділяють на чотири електронні сімейства: s -, p -, d - і f-.
При складанні електронних формул корисно користуватися узагальненими формулами для електронних сімейств (табл.4).
Таблиця 4
Не нашли, что искали? Воспользуйтесь поиском: