
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гибридизация атомных орбиталей и геометрия молекул
Важной характеристикой молекулы, состоящей более чем из двух атомов, является ее геометрическая конфигурация. Она определяется взаимным расположением атомных орбиталей, участвующих в образовании химических связей.
Для объяснения геометрической конфигурации молекулы используется представление о гибридизации АО центрального атома.
Возбужденный атом бериллия имеет конфигурацию 2s12p1, возбужденный атом бора - 2s12p2 и возбужденный атом углерода - 2s12p3. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. Например, в таких соединениях как BeCl2, BeCl3,CCl4 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны.
Основные положения метода гибридизации:
1) Гибридные орбитали образуются из различных атомных орбиталей, не сильно отличающиеся по энергиям,
2) Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации.
3) Гибридные орбитали одинаковы по форме электронного облака и по энергии.
4) По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обусловливают лучшее перекрывание электронных облаков.
Sp- гибридизация
sp–гибридизация имеет место, например, при образовании галогенидов Be, Zn, Co и Hg (II). В валентном состоянии все галогениды металлов содержат на соответствующем энергетическом уровне s и p-неспаренные электроны. При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.

Рис.2 sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
Sp2-гибридизация
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу. Такова, например, конфигурация молекулы BF3:

Рис.3 sp2-гибридизация
Sp3-гибридизация
sp3-гибридизация характерна для соединений углерода. В результате гибридизации одной
s-орбитали и трех р-орбиталей образуются четыре гибридные sp3-орбитали, направленные к вершинам тетраэдра с углом между орбиталями 109,5о. Гибридизация проявляется в полной равноценности связей атома углерода с другими атомами в соединениях, например, в CH4, CCl4, C(CH3)4 и др.
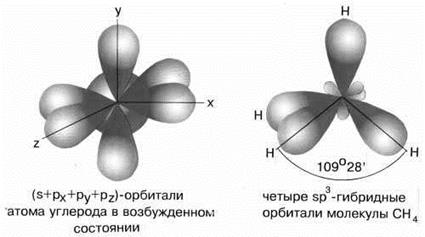
Рис.4 sp3-гибридизация
Теория гибридизации объясняет геометрию молекулы аммиака. В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.

Рис.5 sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Гибридизация объясняет также отличие угла между связями О-Н в угловой молекуле воды. В результате гибридизации 2s и трёх 2p орбиталей кислорода образуются четыре гибридных орбитали sp3, из которых только две участвуют в образовании химической связи, что приводит к искажению угла, соответсвующего тетраэдру.

Рис 6 sp3 - гибридизация в молекуле воды
В гибридизацию могут включаться не только s- и р-, но и d- и f-орбитали.
При sp3d2-гибридизации образуется 6 равноценных облаков. Она наблюдается в таких соединениях как [SiF6]4-, [Fe(CN)6]4-. При этом молекула имеет конфигурацию октаэдра:

Рис. 7 d2sp3-гибридизация в ионе [Fe(CN)6]4-
Представления о гибридизации дают возможность понять такие особенности строения молекул, которые не могут быть объяснены другим способом.
Гибридизация атомных орбиталей (АО) приводит к смещению электронного облака в направлении образования связи с другими атомами. В результате области перекрывания гибридных орбиталей оказываются больше, чем для чистых орбиталей и прочность связи увеличивается.
Не нашли, что искали? Воспользуйтесь поиском: