
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Порядок титрования, кривые титрования в методе нейтрализации.
Правильное определение конечной точки титрования зависит также и от принятого в работе порядка титрования. По методу нейтрализации титрование выполняют от кислоты к щелочи, т.е. приливанием к кислоте щелочи из бюретки или, наоборот. При этом выбор индикатора не безразличен. С метиловым оранжевым титруют от щелочи к кислоте. С фенолфталеином удобнее титровать от кислоты к щелочи, так как при этом бесцветный раствор становиться малиновым.
Иногда для лучшего определения конечной точки титруют с свидетелем. В коническую колбу наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде несколько капель индикатора и приливают из бюретки 1-2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный свидетель используют в качестве образца при титрование, добиваясь, чтобы окраска анализируемого раствора и свидетеля была одинакова.
Наконец, правильное определение конечной точки титрования зависит от количества прибавленного индикатора. Чем больше прибавляется индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления точки эквивалентности имеет значение не столько яркость окраски раствора, сколько четкость ее изменения. Опытным п6
В ходе нейтрализации pH титруемого раствора меняется в зависимости от объема прибавленного стандартного раствора (Vв) и от его титра (Tв). Следовательно, если на оси абсцисс откладывать процентное содержание остающейся в растворе в разные моменты титрования кислоты или щелочи или количество прибавленного стандартного раствора в миллилитрах, а на оси ординат — отвечающие им значения pH раствора, то получается ряд точек, соединив которые, можно представить ход изменения pH в процессе нейтрализации. Каждый процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение величины pH титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи. Построение кривой титрования ведут с таким расчетом, чтобы показать значения pH раствора, соответствующие главнейшим моментам титрования. Значения pH растворов, соответствующие различным моментам титрования, вычисляют по формулам, выражающим значения концентраций ионов водорода в воде, в водных растворах кислот, оснований, гидролизующихся солей и, наконец, в буферных смесях. Значение кривых нейтрализации. Кривые титрования дают возможность проследить изменение pH раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и, как будет показано в дальнейшем, сделать правильный выбор индикатора.
На рис. представлены кривые титрования различных кислот и оснований.
Титрование сильной кислоты сильным основанием. Кривая титрования 0,1 н. раствора NaOH 0,1 н. раствором HCl.

Титрование слабой кислоты сильным основанием. Кривая нейтрализации 0,1 н. раствора CH3COOH 0,1 н. раствором NaOH. 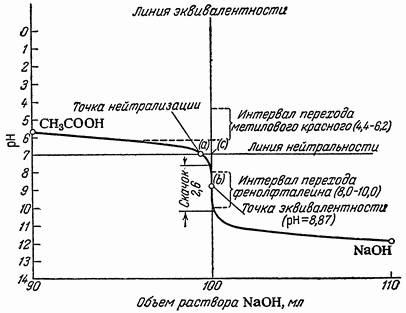
.
Титрование слабого основания сильной кислотой. Кривая нейтрализации 0,1 н. раствора аммиака 0,1 н. раствором HCl.

Не нашли, что искали? Воспользуйтесь поиском: