
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Примеры решения задач. Пример 1. Определить молярную концентрацию раствора NaOH с массовой долей 10% и плотностью r =1,1 г/см3.
Пример 1. Определить молярную концентрацию раствора NaOH с массовой долей 10% и плотностью r =1,1 г/см3.
Р е ш е н и е. 1) Записываем выражение для молярной концентрации раствора NaOH: 
2) 10%-ный раствор – это 10г NaOH в 100г раствора. Находим количество вещества NaOH, содержащееся в 10 г:
 , mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
, mNaOH = 10 г, MNaOH = 23 + 16 +1 = 40 г/моль
 , т.е. 0,25 моль NaOH содержится в 100 г раствора.
, т.е. 0,25 моль NaOH содержится в 100 г раствора.
3) Находим объем раствора массой 100 г:
m =V×r,  = 0,091 л
= 0,091 л
4) Рассчитываем молярную концентрацию:

Ответ: молярная концентрация раствора гидроксида натрия с массовой долей 10% составляет 2,74 моль/л
Пример 2. Найти молярную долю растворенного вещества в растворе сахарозы с массовой долей 67%.
Р е ш е н и е. 1) Вспомним, что молярная доля растворенного вещества равна:
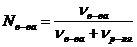
67%-ный (по массе) раствор означает, что в 100 г раствора содержится 67 г сахарозы и 33 г воды.
2) Определяем количество вещества сахарозы и количество вещества воды:
nв-ва = 67/342 = 0,196 моль, nр-ля = 33/18 = 1,83 моль
Следовательно, молярная доля сахарозы равна:

Ответ: молярная доля сахарозы в растворе сахарозы с массовой долей 67% составляет 0,097.
Пример 3. Какой объем серной кислоты с массовой долей 96% (плотностью 1,84 г/см3) и какую массу воды нужно взять для приготовления 100 мл 15%-ного (по массе) раствора H2SO4 (r = 1,10 г/см3).
Р е ш е н и е. 1) Найдем массу 100 мл 15% раствора H2SO4:
mH2SO4-р-ра = V×r = 100×1,10 =110 г
2) Из формулы массовой доли находим массу серной кислоты, содержащейся в этом растворе:
 ; mH2SO4 =
; mH2SO4 = 
3) Найдем массу 96% раствора, содержащего 16,5 г H2SO4:

4) Находим объем 96 %-ного раствора серной кислоты:

Ответ: для приготовления 100мл 15%-ного раствора H2SO4 потребуется 9,3 мл 96%-ного раствора серной кислоты и 110 – 16,5 = 93,5 г воды.
Не нашли, что искали? Воспользуйтесь поиском: