
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Порядок разрядки ионов на катоде
По характеру разрядки катионы металлов подразделяются на три группы:
а) катионы активных металлов, которые стоят в ряду стандартных электродных потенциалов до алюминия (включая его), при электролизе растворов на катоде не восстанавливаются, происходит восстановление ВОДОРОДА;
б) катионы металлов средней активности (после алюминия до водорода) при электролизе растворов восстанавливаются наряду с катионами водорода. Однако восстановление водорода вскоре прекращается из-за большого потенциала перенапряжения, и на катоде идет восстановление только МЕТАЛЛА;
в) катионы неактивных металлов, стоящих в ряду стандартных электродных потенциалов металлов после водорода, восстанавливаются количественно, причем в первую очередь разряжается ион с большим значением j°.
Если же водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения стандартного электродного потенциала соответствующего металла.
Порядок окисления анионов на нерастворимом аноде такой же, как и при электролизе расплавов, т.е. идет окисление ионов с меньшим значением j°. Следует учитывать также потенциал перенапряжения при выделении на аноде кислорода, когда идет разрядка ионов воды. Поэтому вопреки значениям j° на аноде в присутствии ионов ОН- (водный раствор) идет окисление галогенов: J-, Вr-, Сl-, затем иона ОН-. Труднее отдают электроны ионы кислородосодержащих кислотных остатков: SO42-, NO3-, CO32- и т.д.
В качестве нерастворимого анода используется платина, уголь, графит и др.
Примеры:
а) составить схему электролиза раствора хлорида натрия.

 NaCl Na+ + Cl-
NaCl Na+ + Cl-

 H2O H+ + OH-
H2O H+ + OH-
Катод (-) Анод (+)
Na+, H+ Cl-, OH-
Восстановление Окисление
2H+ + 2ē ® H2 2Cl- - 2ē ® Cl2
Натрий активный металл, в ряду стандартных электродных потенциалов он расположен до алюминия, поэтому восстанавливается водород. Щелочные металлы из водных растворов выделить невозможно.
В растворе остаются ионы:

 Na+ + ОН- NаОН
Na+ + ОН- NаОН
б) составить схему электролиза раствора сульфата никеля (II).
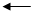
 NiSO4 Ni2+ + SO42-
NiSO4 Ni2+ + SO42-
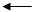
 H2O H+ + OH-
H2O H+ + OH-
Катод (-) Анод (+)
Ni2+, H+ OH-, SO42-
Восстановление Окисление
Ni2+ + 2ē ® Ni 4OH- - 4ē ® 2H2O +O2
Никель – металл средней активности, в ряду стандартных электродных потенциалов он стоит после алюминия до Н2, поэтому восстанавливается металл.
Если в растворе находятся кислородосодержащие анионы, то на аноде окисляются ионы ОН-.
в) в какой последовательности будет происходить разрядка ионов на электродах при электролизе водных растворов электролитов: MgCl2, FeSO4, NaI, Cu(NO3)2?
Диссоциация электролитов:

 MgCl2 Mg2+ + 2Cl-
MgCl2 Mg2+ + 2Cl-

 FeSO4 Fe2+ + SO42-
FeSO4 Fe2+ + SO42-

 NaJ Na+ + J-
NaJ Na+ + J-

 Cu(NO3)2 Cu2+ + 2NO3-
Cu(NO3)2 Cu2+ + 2NO3-
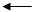
 H2O H+ + OH-
H2O H+ + OH-
Катод (-) Анод (+)
Fe2+ j° = -0,44 В J- j° = 0,536 В
Mg2+ j° = - 2,38 B Сl- j° = 1,359 B
Na+ j° = - 2,74 В OH- j° = 0,401 B
Н+ j = 0,00 SO42- j° = 2,01 B
Cu2+ j° = 0,34 В NO3- j° = B
Восстановление: Окисление:
1. Cu2+ + 2ē ® Cu 1. 2J- - 2ē ® J2
2. Fe2+ + 2ē ® Fe 2. 2Cl- - 2ē ® Cl2
3. 2H+ + 2ē ® H2 3. 4OH- - 4ē ® 2H2O + O2
Не нашли, что искали? Воспользуйтесь поиском: