
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
8 страница. 307. Из сочетания частиц Со3+, NH3, NO и К+ можно составить семь координационных формул комплексных соединений кобальта
307. Из сочетания частиц Со3+, NH3, NO 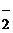 и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
308. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4CI2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+, Напишите формулы соединений, содержащих эти комплексные ионы.
309. Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO3], [Pd(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni4+. Напишите формулы комплексных соединений, содержащих эти ионы.
310. Из сочетания частиц Cr3+, H2O, С1– и К+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
311. Составьте координационные формулы следующих комплексных соединении кобальта: 3NaNO2×Co(NO2)3, CoCl3×3NH3×2H2O, 2KNO2×NH3×Co(NO2)3. Координационное число кобальта(III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах
312. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2–. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
313. Константы нестойкости комплексных ионов [Co(CN)4]2–, [Hg(CN)4]2–, [Cd(CN)4]2–соответственно равны 8×I0–20, 4×10–41, 1,4×10–17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN– больше? Напишите выражения для констант нестойкости указанных комплексных ионов.
314. Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]–, [Ag(NH3)2]+, [Ag(SCN)2]–. Зная, что они соответственно равны 1,0×10–21, 6,8×10–8, 2,0×10–11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+.
315. При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого иона: [Zn(NH3)4]2+ или [Zn(CN)4]2– больше? Почему?
316. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа? Напишите молекулярное и ионное уравнения реакции. Какие комплексные соединения называются двойными солями?
317. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl2×3NH3, PtCl2×NH3×KCl, PtCl2×2NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом?
318. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций.
319. Какие комплексные соединения называются двойными солями? Напишете уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа, если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакции.
320. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,2×10–36; 1,0×10–37; 1,0×10–44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ноны.
s-элементы
Пример 1.
Почему водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в то же время в скобках в первой. Приведите примеры реакций, доказывающих двойственную химическую природу водорода.
Решение.
Особенность строения электронной оболочки атома водорода (как и гелия), а именно отсутствие промежуточного электронного слоя (его валентный электрон находится непосредственно в сфере действия атомного ядра), не позволяет однозначно решить, в какой группе периодической системы он должен находиться. Если исходить из числа валентных электронов его атома, то водород должен находиться в первой группе. Однако, в отличие от щелочных металлов, водород вследствие высокого значения энергии ионизации не способен образовывать ионных соединений, в которых он был бы катионом. Его соединения, даже с наиболее активными неметаллами, например, фтором, представляют вещества с полярной ковалентной связью.
Если же исходить из того, что для завершения внешнего энергетического слоя атому водорода не хватает одного электрона, его следует поместить в седьмую группу. Атом водорода, как и атомы галогенов, характеризуется высоким значением энергии ионизации.
Таким образом, отдавая один электрон, водород проявляет сходство со щелочными металлами первой группы, а присоединяя электрон – с галогенами седьмой группы. Поэтому водород в периодической системе помещают либо в первой группе и в скобках в седьмой, либо в седьмой группе и в скобках в первой. Вместе с тем водород – элемент особый и его размещение в той или иной группе таблицы в значительной мере условно.
Из вышесказанного следует, что в химических процессах водород может выступать в качестве восстановителя при взаимодействии с окислителями, например, хлором:
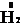 +
+ 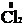 = 2HCl,
= 2HCl,
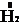 – 2
– 2  = 2
= 2 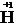 – окисление,
– окисление,
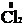 + 2
+ 2  = 2
= 2  – восстановление.
– восстановление.
Водород может проявлять и окислительные свойства при взаимодействии с сильными восстановителями, например, щелочными металлами:
2Me + 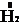 = 2MeH,
= 2MeH,
2 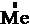 – 2
– 2  = 2
= 2 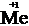 – окисление,
– окисление,
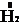 + 2
+ 2  = 2
= 2 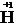 – восстановление.
– восстановление.
Степень окисления водорода в образующихся гидридах металлов – (-1), химическая связь в них ионного типа, в галогеноводородах химическая связь – ковалентная полярная.
Пример 2.
Чем обусловлена высокая химическая активность щелочных металлов? Составьте электронные схемы строения атомов натрия и цезия. У какого из этих элементов ярче выражены металлические свойства и почему?
Решение.
Имея во внешнем энергетическом слое только по одному электрону, находящемуся на сравнительно большом удалении от ядра (за исключением лития), атомы щелочных металлов довольно легко отдают этот электрон, т. е. характеризуются низкой энергией ионизации, что и является причиной их высокой активности. Энергия ионизации уменьшается при переходе от лития к цезию за счет увеличения числа электронных слоев в структуре атома и уменьшения притяжения внешнего валентного электрона к ядру. Химическая активность при этом возрастает.
Составим электронные формулы атомов натрия и цезия:
Na (Z = 11) – 1s2 2s2 2p6 3s1,
Cs (Z = 55) – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d105p6 6s1.
Способность атома элемента отдавать электроны характеризует его металлические свойства, восстановительную активность, и чем легче атомы теряют электроны, тем ярче выражены эти свойства. Следовательно, цезий – элемент с самыми сильными металлическими свойствами не только среди щелочных металлов, но и среди элементов периодической системы.
Пример 3.
Рассмотрите восстановительную способность щелочных металлов на примере взаимодействия лития с кислородом, водородом, хлором, серой, азотом, углеродом и водой.
Решение.
Литий и его аналоги являются сильными восстановителями в окислительно-восстановительных реакциях и проявляют постоянную степень окисления, равную (+ 1).
При сгорании лития в избытке кислорода образуется оксид лития, остальные щелочные металлы образуют пероксиды Me2O2:
4Li + O2 = 2Li2O.
При нагревании в атмосфере водорода литий и его аналоги образуют гидриды, имеющие характер типичных солей, в которых отрицательным ионом является ион водорода:
2Li + H2 = 2LiH.
При взаимодействии с хлором образуются хлориды металлов:
2Li + Cl2 = 2LiCl.
Щелочные металлы при повышенной температуре энергично реагируют с серой, образуя сульфид и дисульфид (Li2S2):
2Li + S = Li2S.
С азотом непосредственно взаимодействует только литий, образуя нитрид Li3N, реакция идет при повышенной температуре:
6Li + N2 = 2Li3N.
Литий также единственный щелочной металл, который непосредственно взаимодействует с углеродом, образуя карбид лития. Эта реакция идет при нагревании:
2Li + 2C = Li2C2.
Литий разлагает воду без плавления по реакции
2Li + 2H2O = LiOH + H2.
Пример 4.
Почему пероксид водорода может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений напишите реакции взаимодействия пероксида водорода с диоксидом свинца в азотнокислой среде, с сульфидом свинца в нейтральной среде.
Решение.
Окислительно-восстановительная двойственность характерна для веществ, содержащих атомы элементов в промежуточной степени окисления. Так, степень окисления кислорода в пероксиде водорода равна (– 1), т. е. имеет промежуточное значение между (– 2) в молекуле воды и (0) в молекулярном кислороде. Поэтому пероксид водорода обладает окислительно-восстановительной двойственностью. Более характерными для него являются окислительные свойства, так как стандартный потенциал электрохимической системы
H2O2 + 2H+ + 2  = 2H2O,
= 2H2O,
в которой H2O2 выступает как окислитель, равный 1,776 В, больше, чем стандартный потенциал (0,682 В) электрохимической системы
O2 + 2H+ + 2  = H2O2,
= H2O2,
где пероксид водорода является восстановителем.
Учитывая окислительно-восстановительную двойственность пероксида водорода составим уравнения реакции, необходимые по условию задачи:
H2O2–1 + Pb+4O2 + 2HNO3 = Pb+2(NO3)2 + O  + 2H2O,
+ 2H2O,
O 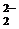 - 2
- 2  = O
= O  – окисление,
– окисление,
Pb+4 + 2  = Pb+2 – восстановление,
= Pb+2 – восстановление,
PbS–2 + 4H2O2–1 = PbS+6O4 + 4H2O–2,
S–2 - 8  = S+6 – окисление,
= S+6 – окисление,
O 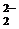 + 2
+ 2  = 2O–2 – восстановление.
= 2O–2 – восстановление.
Пример 5.
Допишите уравнения реакций:
1. Na2O2 + KI + H2SO4 ®
2. Na2O2 + Fe(OH)2 + H2O ®
3. Na2O2 + KMnO4 + H2SO4 ®
4. Na2O2 + H2O ®
5. Na2O2 + H2SO4 ®
Окислителем или восстановителем является пероксид натрия в этих реакциях?
Решение.
Пероксид натрия очень сильный окислитель. При взаимодействии с восстановителями KI и Fe(OH)2 (реакции 1 и 2) он проявляет окислительные свойства:
Na2O2 + 2KJ– + 2H2SO4 = J20 + Na2SO4 + K2SO4 + 2H2O–,
1| 2J– – 2  = J20,
= J20,
1| O 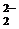 + 2
+ 2  = 2O–2,
= 2O–2,
Na2O2 + 2Fe(OH)2 + 2H2O = 2Fe(OH)3 + 2NaOH,
1 | O 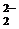 + 2
+ 2  = 2O–2,
= 2O–2,
2 | Fe+2 – 1  = Fe+3,
= Fe+3,
Восстановительные свойства менее характерны для Na2O2, но при взаимодействии с сильными окислителями KMnO4 (реакция 3) он проявляет восстановительные свойства:
5Na2O2 + 2KMn+7O4 + 8H2SO4 =
= 5O20 + 2Mn+2SO4 + K2SO4 + 5Na2SO4 + 8H2O.
2 | Mn+7 + 5  = Mn+2,
= Mn+2,
5 | O 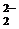 – 2
– 2  = 2O–2.
= 2O–2.
При осторожном растворении пероксида натрия в холодной воде
(реакция 4) получается раствор, содержащий гидроксид натрия и пероксид водорода. Взаимодействие пероксида натрия с водой – это реакция гидролиза соли, образованной слабой кислотой H2O2 и сильным основанием NaOH:
O 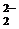 + 2H2O
+ 2H2O  H2O2 + 2OH–,
H2O2 + 2OH–,
Na2O2 + 2H2O  H2O2 + 2NaOH.
H2O2 + 2NaOH.
При взаимодействии с разбавленными кислотами (реакция 5) также получается пероксид водорода:
Na2O2 + H2SO4 = Na2SO4 + H2O2.
Пример 6.
Вычислите объем кислорода (при нормальных условиях), выделивше-гося при получении 4,6 кг металлического натрия электролизом расплава едкого натрия.
Решение.
Схема электролиза расплава едкого натрия:
NaOH  Na+ + OH–,
Na+ + OH–,
катод (–) – Na+ +  = Na0;
= Na0;
анод (+) – 4OH– – 4  = O2 + 2H2O.
= O2 + 2H2O.
Согласно второму закону Фарадея, одинаковые количества электричества выделяют на электродах эквивалентные массы веществ. Определим, сколько эквивалентов содержится в 4,6 кг металлического натрия. Молярная масса эквивалента натрия равна 23 г/моль, следовательно, в 4,6 кг (4600 г) натрия содержится:  = 200 экв.
= 200 экв.
На аноде также выделится 200 экв. кислорода. Рассчитаем, сколько это составит литров. Объем 1 экв. кислорода равен 5,6 л, а 200 экв. кислорода:
200 × 5,6 = 1120 л.
Итак, при электролизе расплава гидроксида натрия на аноде выделится при нормальных условиях 1120 л кислорода.
Пример 7.
Какие из газов (H2S, H2, Cl2, CO2, SO2) будут поглощаться при пропускании их через раствор гидроксида натрия? Напишите уравнения соответствующих реакций.
Решение.
При пропускании хлора через раствор гидроксида натрия идет реакция диспропорционирования с образованием хлорида и гипохлорита натрия:
2NaOH + Cl2 = NaCl + NaClO + H2O.
Гидроксид натрия поглощает углекислый газ и оксид серы с образованием кислых солей NaHCO3 и NaHSO3 соответственно:
NaOH + CO2 = NaHCO3,
NaOH + SO2 = NaHSO3.
Пример 8.
Основываясь на строении электронной оболочки атома бериллия, объясните амфотерные свойства гидроксида бериллия. Напишите ионно-молекулярные уравнения взаимодействия гидроксида бериллия со щелочью и кислотой.
Решение.
Электронная формула атома бериллия 1s2 2s1.
Второй снаружи электронный слой содержит два электрона, а не восемь, как у остальных s-элементов (за исключением лития). Это приводит к значительному снижению атомного радиуса, увеличению энергии ионизации, снижению его химической активности. Бериллий среди s-элементов обладает наиболее слабыми металлическими свойствами. Связь в соединениях бериллия имеет очень сильный ковалентный характер. Отличие строения атома бериллия от строения атомов щелочноземельных элементов сказывается и на свойствах соединений. Так, гидроксид бериллия Be(OH)2 – единственный в подгруппе гидроксид, обладающий амфотерными свойствами.
Напишем реакции взаимодействия гидроксида бериллия с кислотой и со щелочью:
Be(OH)2 + 2HCl = BeCl2 + H2O,
Be(OH)2 + 2H+ + 2Cl– = Be2+ + 2Cl– + H2O,
Be(OH)2 + 2H+ = Be2+ + H2O,
Be(OH)2 + 2NaOH = Na2[Be(OH)4],
Be(OH)2 + 2Na+ + 2OH– = 2Na+ + [Be(OH)4]2–,
Be(OH)2 + 2OH– = [Be(OH)4]2–.
Пример 9.
Напишите реакции получения нитрида и гидроксида бария и разложения их водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
Решение.
Уже при комнатной температуре щелочноземельные металлы медленно взаимодействуют с азотом, образуя нитриды. Для получения нитридов металлы нагревают до 900 °С в атмосфере азота. Процесс протекает по уравнению
3Ba0 + N  = Ba
= Ba 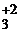 N
N 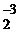 .
.
3 | Ba0 – 2  = Ba+2,
= Ba+2,
1 | N  + 6
+ 6  = 2N–3.
= 2N–3.
Разложение нитрида бария водой протекает по реакции
Ba3N2 + 6H2O = 3Ba(OH)2 + 2NH3.
Щелочноземельные металлы соединяются с водородом, образуя гидриды, аналогичные гидридам щелочных металлов:
Ba0 + H20 = Ba+2H2-1.
H20 + 2  = 2H–1,
= 2H–1,
Ba0 – 2  = Ba+2.
= Ba+2.
Гидрид бария бурно реагирует с водой, выделяя водород:
BaH2–1 + 2H2O = Ba(OH)2 + 2H  .
.
2H–1 – 2  = H
= H  ,
,
2H+1 + 2  = H
= H  .
.
Пример 10.
Как взаимодействуют с водой элементы главной подгруппы второй группы? Почему бериллий нерастворим в воде, магний плохо растворим, а кальций, стронций и барий хорошо растворимы?
Решение.
Необходимым условием реакции металла с водой является удаление с его поверхности оксидной пленки с образованием растворимого гидроксида.
Теоретически бериллий должен раствориться в воде (значение электродного потенциала данной реакции – 1,85 В), но защитная пленка оксида бериллия препятствует взаимодействию бериллия с водой, так как BeO не взаимодействует с водой ни при каких условиях.
Защитные свойства оксидной пленки магния и других щелочноземельных металлов значительно слабее. С холодной водой магний взаимодействует очень медленно. Так как образующийся гидроксид магния плохо растворим в воде, при нагревании реакция ускоряется за счет увеличения растворимости гидроксида. Реакция идет в две стадии с образованием вначале оксида, который затем при гидратации дает гидроксид магния:
Mg + H2O = MgO + H2,
MgO + H2O = Mg(OH)2.
Щелочноземельные металлы взаимодействуют с водой, вытесняя из нее водород и образуя растворимые гидроксиды:
Ba + 2H2O = Ba(OH)2 + H2.
Пример 11.
Как получают негашеную и гашеную известь, известковую воду и известковый раствор? Что происходит на воздухе с известковой водой?
Решение.
В технике оксид кальция называют негашеной известью и получают ее при обжиге карбоната кальция в шахтной печи по реакции
CaCO3 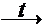 CaO + CO2.
CaO + CO2.
Гашеная известь Ca(OH)2 образуется при взаимодействии оксида кальция с водой (процесс гашения):
CaO + H2O = Ca(OH)2.
Насыщенный раствор гидроксида кальция называется известковой водой и имеет щелочную реакцию. На воздухе известковая вода быстро становится мутной вследствие поглощения ею углекислого газа и образования нерастворимого карбоната кальция:
Ca(OH)2 + CO2 = CaCO3¯ + H2O.
Гашеную известь широко используют в строительном деле. Смесь её с песком и водой называется известковым раствором и служит для скрепления кирпичей при кладке стен.
Задания
321. Приведите уравнение реакции образования комплексного соединения при взаимодействии BeCl2 и КОН. Какое число лигандов координирует в данном соединении ион Ве2+? Какие атомные орбитали предоставляет Ве2+ для образования связей по донорно-акцепторному механизму? Напишите электронную конфигурацию лиганда.
322. Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
323. Напишите уравнения реакций с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N.
324. Как получают металлический натрий?. Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
325. Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций H2O2: а) с Ag2O; б) с NaI.
326. Почему пероксид водорода способен диспропорционировать (самоокисляться – самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения H2O2.
327. Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
328. Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
329. Гидроксид какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого гидроксида: а) с кислотой, б) со щелочью.
330. При пропускании диоксида углерода через известковую воду (раствор Ca(OH)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
331. Составьте электронные и молекулярные уравнения реакций: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой; имея в виду максимальное восстановление последней.
332. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
333. Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства?
Не нашли, что искали? Воспользуйтесь поиском: