
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Понятие энтропии в физике
Введение понятия энтропия связано со вторым началом термодинамики, которое представляет собой распространение закона сохранения и взаимопревращения энергии на тепловые явления. Содержание второго начала термодинамики сводится к двум утверждениям: существует функция состояния системы – энетропи /289 с.100 2а/  /289 с.100 3а/ (где Т – абсолютная температура, δQ – количество тепла; S – энтропия) и как функция состояния энтропия является аддитивной величиной; закон возрастания энтропии, который определяет динамику развития неравновесного состояния системы /289 с.100 на/. Для изолированных систем
/289 с.100 3а/ (где Т – абсолютная температура, δQ – количество тепла; S – энтропия) и как функция состояния энтропия является аддитивной величиной; закон возрастания энтропии, который определяет динамику развития неравновесного состояния системы /289 с.100 на/. Для изолированных систем  (10) /289 с.101 1а/ и энтропия для таких систем возрастает и по мере достижения равновесного состояния достигает максимума. В этом состоянии для системы характерен максимальный беспорядок. Энтропия является мерой хаотичности, неупорядоченности, а, стало быть, и мерой упорядоченности системы /289 с.101 2а/.
(10) /289 с.101 1а/ и энтропия для таких систем возрастает и по мере достижения равновесного состояния достигает максимума. В этом состоянии для системы характерен максимальный беспорядок. Энтропия является мерой хаотичности, неупорядоченности, а, стало быть, и мерой упорядоченности системы /289 с.101 2а/.
Говоря о порядке в системе, имеют в виду наличие определённой структуры, характеризуемой соответствующей симметрией. Возможность образования структуры связана с наличием корреляций в системе. Энтропия связана с наличием корреляций в системе. Энтропию нельзя представить как среднее значение какой-либо аддитивной или бинарной динамической величины и в общем случае для равновесного состояния имеет место соотношение /289 с.101 3а/:
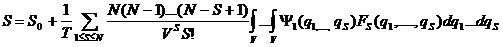 /289 с.101 4а/, где S0 – энтропия идеального газа; N – число частиц системы; q – координаты частиц; ψS – "корреляционные" потенциалы; FS – корреляционные функции. В частности, вклад в энтропию парных корреляций в однородном случае /289 с.101 5а/:
/289 с.101 4а/, где S0 – энтропия идеального газа; N – число частиц системы; q – координаты частиц; ψS – "корреляционные" потенциалы; FS – корреляционные функции. В частности, вклад в энтропию парных корреляций в однородном случае /289 с.101 5а/:
 /289 с.101 на/. Здесь k – постоянная Больцмана; g(r) – парная корреляционная функция; V – средний объем на частицу в системе. Таким образом, появление корреляций (можно сказать "порядка") приводит к уменьшению энтропии системы /289 с.102 1а/.
/289 с.101 на/. Здесь k – постоянная Больцмана; g(r) – парная корреляционная функция; V – средний объем на частицу в системе. Таким образом, появление корреляций (можно сказать "порядка") приводит к уменьшению энтропии системы /289 с.102 1а/.
Сильно неравновесное состояние характеризуется отличными от нуля многочастичными корреляционными функциями, которые при приближении системы к равновесному состоянию, распадаются. Энтропия связана с корреляциями и закон изменения энтропии обусловлен конкретной природой динамики корреляций рассматриваемой системы. Общее правило изменения энтропии типа неравенства (10) ограницивает возможные пути релаксации системы к равновесному состоянию. Неравновесная термодинамика и особенно термодинамика открытых систем в настоящее время находится на стадии интенсивного развития. Например, отличие турбулентного движения жидкости от ламинарного заключается в том, что в первом случае движение частиц жидкости коррелированно на масштабах турбулентного вихря, в то время как в случае ламинарного движения нет каких-либо корреляций в движении частиц жидкости и таким образом энтропия турбулентного движения меньше, чем у ламинарного движения. Получается, что турбулентное движение жидкости более упорядоченно, чем ламинарное, хотя недавно считалось наоборот. Для открытых систем имеет место "S-теорема", позволяющая определить критерий относительной степени упорядоченности состояний открытых систем. В статистической теории открытых систем энтропия может играть три разные роли: служить мерой неопределённости при статистическом описании, мерой относительной степени упорядоченности неравновесных состояний и мерой разнообразия в теории эволюции /289 с.102 на/.
Не нашли, что искали? Воспользуйтесь поиском: