
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
АДСОРБЦИЯ НА ГРАНИЦЕ ЖИДКОЙ И ТВЕРДОЙ ФАЗ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Адсорбция, адсорбент, адсорбат, десорбция
Адсорбция представляет собой процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой. Адсорбция относится к явлениям, происходящим вследствие стремления к самопроизвольному снижению поверхностного натяжения. Адсорбция может наблюдаться в многокомпонентных системах. В этом случае в поверхностный слой предпочтительнее переходит тот компонент, который сильнее уменьшает межфазное (поверхностное) натяжение. В однокомпонентной системе при формировании поверхностного слоя происходит изменение его структуры (сгущение, уплотнение), которое часто называют автоадсорбцией.
В общем случае адсорбция может происходить не только благодаря стремлению поверхностной энергии к уменьшению. Она может быть результатом химического взаимодействия компонента с поверхностью вещества, и тогда поверхностная энергия может даже возрастать на фоне уменьшения энергии всей системы.
Принято более плотную фазу (вещество, на поверхности которого происходит адсорбция) называть адсорбентом. Он может быть твердым и жидким. Вещество, которое перераспределяется и поэтому обычно находится в газообразной или жидкой фазе, называется адсорбатом. Таким образом, адсорбат адсорбируется на поверхности адсорбента. Обратный процесс перехода вещества из поверхностного слоя в объемную фазу называется десорбцией.
В зависимости от агрегатного состояния смежных фаз различают адсорбцию газов на твердых адсорбентах, адсорбцию растворенных веществ на границах твердое тело – жидкость и жидкость – жидкость, а также адсорбцию на границе жидкость – газ.
Для количественного описания адсорбции применяют в основном две величины. Одна измеряется числом молей или граммов, приходящимся на единицу поверхности или на единицу массы адсорбента (для твердого в порошкообразном состоянии); ее принято обозначать буквой А. Другая характеристика определяется избытком вещества в поверхностном слое по сравнению с его количеством в таком же объеме фазы, также отнесенным к единице площади поверхности или единице массы адсорбента. Эту величину называют гиббсовской адсорбцией и обозначают буквой Г.
По механизму процесса адсорбции выделяют физическую (молекулярную) адсорбцию, хемосорбцию (химическое присоединение атома, молекулы) и ионный обмен.
Для физической адсорбции характерно взаимодействие адсорбента и адсорбата за счет сил Ван-дер-Ваальса и водородных связей – обеспечивают протяжение. На очень близком расстоянии проявляются короткодействующие силы отталкивания.
Одним из важных практических выводов является значительно лучшая адсорбция в трещинах и порах, когда проявляется дисперсионное взаимодействие. Если же в адсорбционном взаимодействии значителен электростатический вклад, то в щелях и порах положительные и отрицательные заряды компенсируют друг друга и наибольший потенциал оказывается на выступах, где и будет преобладать адсорбция, особенно при образовании водородных связей. Кроме того, чем большее число атомов имеет молекула адсорбата, тем с большей энергией она будет притягиваться к адсорбенту.
Химическая адсорбция (хемосорбция) отличается от физической силами химической природы между адсорбентом и адсорбатом. При хемосорбции может теряться индивидуальность исходных компонентов. Сильная хемосорбция часто необратима, вместо адсорбированного вещества может десорбироваться другое соединение. Нередко физическая адсорбция предшествует хемосорбции.
Движущей силой адсорбции является разность химических потенциалов компонентов в объёме и на поверхности, которые со временем выравниваются. В результате наступает адсорбционное равновесие.
Если после установления адсорбционного равновесия давление в системе уменьшить до нуля, то начинается процесс десорбции.
Энергия, необходимая для закрепления молекул на поверхности, называется энергией активации адсорбции.
В отличие от адсорбции на телах с ровной поверхностью адсорбция на пористых телах существенно зависит от структуры пористого тела, от его пористости и размера пор. При малых давлениях закономерности адсорбции в макропористых и переходнопористых адсорбентах определяются, главным образом, природой взаимодействующих компонентов. С увеличением давления газа и пара начинают действовать капиллярные силы в переходных порах. Для микропористых адсорбентов дополнительную роль играет молекулярно-ситовой эффект.
При адсорбции на пористых телах появляется стадия переноса вещества внутри пор, для которой характерен диффузионный механизм.
При адсорбции из жидких растворов поверхность адсорбента всегда полностью занята молекулами растворителя и растворённого вещества. Растворённое вещество может адсорбироваться, вытесняя из поверхностного слоя молекулы растворителя.
Ионообменная адсорбция из растворов наблюдается на поверхностях достаточно выраженным двойным электрическим слоем. Подвижные противоионы электрического поля способны обмениваться на другие ионы того же знака, находящиеся в растворе [2,3].
Адсорбция на поверхности твердых тел: изотермы Лангмюра, Генри, Фрейндлиха. Теория полимолекулярной адсорбции
Закон Генри 
Предположим, что поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое. Если поверхностный слой представить как отдельную фазу, то можно рассматривать процесс перераспределения вещества как выравнивание химических потенциалов распределяемого вещества в адсорбционном слое  и в объемной фазе
и в объемной фазе  до
до  =
=  .
.
Используя определение термодинамической активности
 (5.1)
(5.1)
и
 , (5.2)
, (5.2)
получаем
 . (5.3)
. (5.3)
Для неэлектролитов  и тогда
и тогда
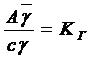 ,
,

или
 , (5.4)
, (5.4)
где А – величина адсорбции – концентрация адсорбата в адсорбционном слое или количество вещества в адсорбционном слое, приходящееся на единицу поверхности; g,  – коэффициенты активности адсорбата в адсорбционном слое и объемной фазе соответственно; D – коэффициент распределения.
– коэффициенты активности адсорбата в адсорбционном слое и объемной фазе соответственно; D – коэффициент распределения.
Уравнения (5.4) отражают изотерму адсорбции в самом общем виде, но коэффициенты активности, как и величина адсорбции, зависят от концентрации. Так как в бесконенчно разбавленном растворе коэффициенты активности равны единице, то на основании уравнения (5.4) можно сформулировать следующую закономерность: при разбавлении системы коэффициент распределения стремится к постоянному значению, равному константе распределения Генри. В этом и состоит закон Генри. Относительно величины адсорбции А этот закон запишется следующим образом:
 ,
,
 , (5.5)
, (5.5)
где p – давление газа или пара, которое связано с концентрацией согласно уравнению Менделеева- Клапейрона, для идеального газа p=cRT, т. е.
 . (5.6)
. (5.6)
Уравнения (5.5) и (5.6) представляют собой изотермы адсорбции вещества при малых концентрациях.
Не нашли, что искали? Воспользуйтесь поиском: