
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
РАСТВОРЫ ЭЛЕКТРОЛИТОВ. СЛАБЫЕ ЭЛЕКТРОЛИТЫ. КОНСТАНТА И СТЕПЕНЬ ДИССОЦИАЦИИ
При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие

константа которого (константа диссоциации) связана с концентрациями соответствующих частиц соотношением: 
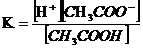
Степенью диссоциации 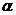 электролита называется доля его молекул, подвергшихся диссоциации, т. е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
электролита называется доля его молекул, подвергшихся диссоциации, т. е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
В случае электролита АХ, диссоциирующего на ионы  и
и  , константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):
, константа и степень диссоциации связаны соотношением (закон разбавления Оствальда):

 /(1-
/(1- 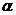 )
)
Здесь  - молярная концентрация электролита, моль/л.
- молярная концентрация электролита, моль/л.
Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1-  1. Тогда выражение закона разбавления упрощается:
1. Тогда выражение закона разбавления упрощается:
К= 
 , откуда
, откуда 
Последнее соотношение показывает, что при разбавлении раствора (т. е. при уменьшении концентрации электролита  ) степень диссоциации электролита возрастает.
) степень диссоциации электролита возрастает.
Если в растворе электролита АХ степень его диссоциации равна 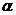 , то концентрации ионов
, то концентрации ионов  и
и  в растворе одинаковы и составляют:
в растворе одинаковы и составляют:
 =
= 
Подставив сюда значение 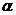 из предыдущего соотношения, находим:
из предыдущего соотношения, находим:
 =
= 

Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой К, а так называемым показателем константы диссоциации рК, который определяется соотношением
рК= -lgК
Очевидно, что с возрастанием К, т. е. с увеличением силы кислоты, значение рК уменьшается: следовательно, чем больше рК, тем слабее кислота.
Пример 1
Степень диссоциации уксусной кислоты в 0,1М растворе = 1,32*10-2. Найти константу диссоциации кислоты и значение рК.
Решение. Подставим данные задачи в уравнение закона разбавления

Откуда рК=-lg (1,77*10 
Расчет по приближенной формуле К=  приводит к близкому значению К
приводит к близкому значению К
К=(1,32*10 
Откуда рК=4,76.
Пример 2
Константа диссоциации циановодорода (синильной кислоты) равна 7,9*10  . Найти степень диссоциации НCN в 0,001 М растворе.
. Найти степень диссоциации НCN в 0,001 М растворе.
Решение. Поскольку константа диссоциации HCN очень мала, то для расчета можно воспользоваться приближенной формулой:

Задачи.
92. Нужно приготовить раствор, содержащий в 1л 0,5моля NaCl, 0,16 моля KCl, 0,24 моля K2SО4. Как это сделать, имея в своем распоряжении только NaCl, KCl и Nа2SО4?
93. Константа диссоциации масляной кислоты С3Н7СООН 1,5*10  . Вычислить степень ее диссоциации в 0,005 М растворе.
. Вычислить степень ее диссоциации в 0,005 М растворе.
94. Найти степень диссоциации хлорноватистой кислоты НОCl в 0,2 н. растворе.
95. Степень диссоциации муравьиной кислоты HCOOH в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты и значение рК.
96. Степень диссоциации угольной кислоты H2СО3 по первой ступени в 0,1 н. растворе равна 2,11*10  . Вычислить К
. Вычислить К  .
.
97. При какой концентрации раствора степень диссоциации азотистой кислоты HNO  будет равна 0,2?
будет равна 0,2?
98. В 0,1 н. растворе степень диссоциации уксусной кислоты равна 1,32*10  .При какой концентрации азотистой кислоты HNO
.При какой концентрации азотистой кислоты HNO  ее степень диссоциации будет такой же?
ее степень диссоциации будет такой же?
99. Сколько воды нужно прибавить к 300 мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась?
100. Чему равна концентрация ионов водорода Н  в водном растворе муравьиной кислоты, если
в водном растворе муравьиной кислоты, если 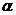 равна 0,03?
равна 0,03?
101. Вычислить  в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
102. Вычислить  ,
,  и
и  в 0,05 М растворе Н
в 0,05 М растворе Н  Se.
Se.
103. Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,005 М раствора уксусной кислоты добавить 0,05 моля ацетата натрия?
104. Рассчитать концентрацию ионов СН3СОО- в растворе, 1 л которого содержит 1 моль СН  СООН и 0,1 моля НCl, считая диссоциацию последнего полной.
СООН и 0,1 моля НCl, считая диссоциацию последнего полной.
105. Исходя из значений последовательных констант диссоциации ортофосфорной кислоты, определить знак изменения энергии Гиббса для каждой из трех ступеней диссоциации. Для какой из них  имеет наибольшее абсолютное значение?
имеет наибольшее абсолютное значение?
106. Раствор, содержащий 2,1 г. КОН в 250 г воды, замерзает при -0,519  . Найти для этого раствора изотонический коэффициент.
. Найти для этого раствора изотонический коэффициент.
107. При нуле градусов осмотическое давление 0,1 н. раствора карбоната калия равно 272,6 кПа. Определить кажущуюся степень диссоциации соли.
108. Раствор, содержащий 0,53 г карбоната натрия в 200г воды, кристаллизуется при -0,13  С. Вычислить кажущуюся степень диссоциации соли.
С. Вычислить кажущуюся степень диссоциации соли.
109. В равных количествах воды растворено в одном случае 0,5 моля сахара, а в другом - 0,2 моля CaСl  . Температуры кристаллизации обоих растворах одинаковы. Определить кажущуюся степень диссоциации CaCl
. Температуры кристаллизации обоих растворах одинаковы. Определить кажущуюся степень диссоциации CaCl  .
.
110. При100  давление пара раствора содержащего 0,05 моля сульфата натрия в 450г воды, равно 100,8 кПа (756,2 мм. рт. ст.). Определить кажущуюся степень диссоциации Na2SО4.
давление пара раствора содержащего 0,05 моля сульфата натрия в 450г воды, равно 100,8 кПа (756,2 мм. рт. ст.). Определить кажущуюся степень диссоциации Na2SО4.
111. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26* 10  ее молекул и ионов. Определить степень диссоциации уксусной кислоты.
ее молекул и ионов. Определить степень диссоциации уксусной кислоты.
112. Кажущаяся степень диссоциации хлорида калия в 0,1 н. растворе равна 0,80. Чему равно осмотическое давление этого раствора при 17 
Не нашли, что искали? Воспользуйтесь поиском: