
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Окислительно-восстановительные реакции.
Пример 1. Исходя из степеней окисления хрома и селена, определите, какие из веществ (К2СrO4, Cr, Cr2O3, Na2Cr2O7, SeO3, Na2Se, Se) в процессе ОВР могут проявлять: а) только окислительные свойства; б) только восстановительные свойства; в) как окислительные, так и восстановительные свойства?
Решение. Только окислительные свойства могут проявлять вещества, содержащие атомы элемента в высшей степени окисления. Высшая степень окисления хрома (VI B-подгруппа, валентные электроны 3d54s1) и селена (VI A-подгруппа, валентные электроны 4s24p4) равна +6, так как атом каждого из этих элементов может отдать 6 электронов. Такая степень окисления имеется в K2CrO4, Na2Cr2O7, SeO3.
Только восстановительные свойства могут проявлять вещества, содержащие атомы элемента в низшей степени окисления. До образования устойчивой электронной структуры 4s24p6 у атома селена не хватает двух электронов, которые он может принять, поэтому низшая степень окисления селена равна –2. Этому соответствует Na2Se. Металлы, к которым относится и хром, могут только отдавать электроны, но не могут их принимать. Поэтому низшая степень окисления хрома равна нулю, т. е. это металлический хром Cr0.
В соединениях  , Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства.
, Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства.
Пример 2. ОВР протекают по схемам:
1) FeSO4 + К2Cr2О7 + H2SO4  Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
2) К2МnО4 + Н2О  КMnО4 + МnО2 + КОН
КMnО4 + МnО2 + КОН
Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на их основании расставьте коэффициенты в уравнениях реакций.
Решение. 1) В схеме реакции расставим изменяющиеся степени окисления:



Определим характер процессов:


 – увеличение степени окисления; процесс окисления;
– увеличение степени окисления; процесс окисления;


 – уменьшение степени окисления; процесс восстановления.
– уменьшение степени окисления; процесс восстановления.
 – восстановитель,
– восстановитель,  – окислитель.
– окислитель.
В данной реакции окислитель и восстановитель различные вещества. Такие реакции называются межмолекулярными.
Составляем электронные уравнения:
 – процесс окисления;
– процесс окисления;
 – процесс восстановления.
– процесс восстановления.
(Коэффициенты удваиваем, так как в каждом моль K2Cr2O7, Cr2(SO4)3, Fe2(SO4)3 содержатся по два моль  соответственно).
соответственно).
Поскольку число электронов, отдаваемых восстановителем, должно равняться числу электронов, принимаемых окислителем, умножим электронные уравнения на соответствующие коэффициенты:

Подставляем эти коэффициенты в схему реакции
6FeSO4 + K2Cr2O7 + H2SO4  3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Находим подбором и расставляем остальные коэффициенты
6FeSO4 + K2Cr2O7 + 7H2SO4  3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Окончательная проверка правильности написания уравнения проводится по балансу атомов кислорода.
6·4 + 7 + 7·4 = 3·3·4 + 3·4 + 4 + 7,
59 = 59.
2) В результате аналогичных действий получим:
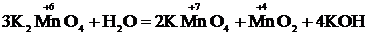

– процесс окисления;
– процесс восстановления.
Здесь и окислителем, и восстановителем является атом одного и того же элемента в промежуточной степени окисления, содержащийся в одной и той же молекуле ( в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.
в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.
Задания
121-140. Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций.
| Номер задачи | Схемы реакций |
| Gе + HNO3 → H2GeO3 + NO2 + H2O | |
| H2S + Cl2 + H2O → H2SO4 + HCl | |
| MgH2 + Н2O → Mg(OH)2 + Н2 | |
| Si + HNO3 + HF → H2SiF6 + NO + H2O | |
| Ge + KOH + O2 → K2GеО3 + H2O | |
| HCl + CrO3 → Cl2 + CrCl3 + H2O | |
| Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H2O | |
| P + KClO3 → P2O5 + KCl | |
| Cr2O3 + KNO3 + KOH → K2CrO4 + KNO2 + H2O | |
| HNO3 + H2S H2SO4 + NO + H2O | |
| Si + O2 + NaOH → Na2SiO3 + H2O | |
| HNO3 + Bi → NO + Bi(NO3)3 + H2O | |
| K2S + KMnO4 + H2SO4 → S + MnSO4 + H2O | |
| Cu2O + HNO3 → Cu(NO3)2 + NO + H2O | |
| РН3 + O2 → H3PO4 | |
| Cu + H2SO4(конц.) → CuSO4 + SO2 + H2O | |
| Na2MnO4 + H2SO4 → NaMnO4 + MnO2 + H2O + Na2SO4 | |
| HNO3 + Al → Al(NO3)3 + NH4NO3 + H2O | |
| KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O | |
| SO2 + HNO3 + H2O → NO + H2SO4 | |
| Mn(OH)2 + Cl2 + KOH → MnO2 + KCl + H2O | |
| PbS + HNO3 → S + Pb(NO3)2 + NO + H2O | |
| NaNO2 + Cl2 + NaOH → NaNO3 + NaCl + H2O | |
| HNO3 + Zn → N2 + Zn(NO3)2 + H2O | |
| Номер задачи | Схемы реакций |
| CaH2 + HCl → CaCl2 + H2 | |
| Cu + HNO3 → NO + Cu(NO3)2 + H2O | |
| Au + HNO3 + HCl → H[AuCl4] + NO + H2O | |
| CO + MnO2 → MnCO3 | |
| P + HNO3 + H2O → H3PO4 + NO | |
| Cl2 + H2O → HClO + HCl | |
| K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + K2SO4 + H2O | |
| Fe(OH)2 + NaBrO + H2O → Fe(OH)3 + NaBr | |
| MnCl2 + Cl2 + KOH → MnO2 + KCl + H2O | |
| HNO3 + Cu → Cu(NO3)2 + NO2 + H2O | |
| PdCl2 + CO + H2O → Pd + CO2 + HCl | |
| P + HIO3 + H2O → H3PO4 + HI | |
| NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O | |
| H2O + F2 → HF + O2 | |
| Al + NaOH + H2O → Na[Al(OH)4] + H2 | |
| H2SO4(конц.) + Mg → MgSO4 + H2S + H2O |
Не нашли, что искали? Воспользуйтесь поиском: