
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Приготовление раствора заданной концентрации разбавлением концентрированного раствора
Выполнение работы
1. Получите от преподавателя задание - приготовить из концентрированного раствора определённый объём раствора меньшей концентрации.
2. Рассчитайте, сколько (мл) исходного раствора требуется для приготовления раствора заданной концентрации. Зная эту величину, найдите объём воды, необходимой для получения этого раствора. Для нахождения плотности раствора пользуйтесь таблицами. Проведённые расчёты представьте преподавателю.
3. После проверки преподавателем, приготовьте заданный раствор смешением найденных объёмов исходного раствора и воды. Для приготовления раствора определённой концентрации используйте: мерную колбу, мерный цилиндр и пипетку, при помощи которой определённый объём жидкости перенесите в мерную колбу. В мерной колбе этот раствор долейте водой до метки и перемешайте. Прибавление воды до метки производится сначала быстро, затем, когда до метки останется 1-2 см, по каплям. Отсчёт уровня жидкости в мерной колбе и мерном цилиндре производится по нижнему краю мениска. Перемешивание раствора в колбе осуществляется путём её переворачивания и встряхивания.
4. Приготовленный раствор сдайте дежурному лаборанту.
Пример расчёта:
Требуется приготовить 50 мл 0,05 N раствора Na2CO3 из 0,2 М раствора Na2CO3, если f экв.(Na2CO3) = 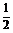 .
.
Расчёт:  = 0,05 . 0,05 = 0,0025 (моль);
= 0,05 . 0,05 = 0,0025 (моль); 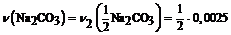 = 0,00125 (моль);
= 0,00125 (моль);

 = 0,00625 л или 6,25 мл 0,2 М раствора.
= 0,00625 л или 6,25 мл 0,2 М раствора.
ЗАНЯТИЕ 2
Тема: Растворы сильных и слабых электролитов
В водных растворах сильные электролиты полностью диссоциированы на ионы. Эффективную, условную молярную концентрацию иона называют
активностью (а) иона (i). Она равна аi = ¦.C i, где ¦ - коэффициент активности. Коэффициент активности для различных ионов изменяется при изменении концентрации раствора: в концентрированных растворах ¦ < 1, а в разбавленных приближается к единице.
Раствор электролита характеризуется ионной силой раствора (I), которая вычисляется по уравнению  , где
, где
C i - молярная концентрация i -того иона;
Z i - заряд i -того иона в единицах заряда электрона.
Между коэффициентом активности и ионной силой раствора существует зависимость: 
В отличие от сильных электролитов в водных растворах слабых электролитов не все молекулы электролита распадаются на ионы, а лишь небольшая их часть. Этот процесс количественно характеризуется степенью электролитической диссоциации (a), которая в зависимости от силы электролита принимает значения 0 < a < 1; для сильных электролитов a > 0,3, для слабых a < 0,03, а для электролитов средней силы 0,03 < a < 0,3. Степень электролитической диссоциации равна 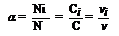 , где
, где
N i - число молекул электролита, распавшихся на ионы;
N- общее число молекул электролита в растворе (число молекул электролита, введенных в растворитель);
С i - молярная концентрация молекул электролита, распавшихся на ионы;
С - молярная концентрация электролита;
n i - количество вещества электролита, распавшегося на ионы;
n- количество вещества электролита, введённого в раствор.
Степень электролитической диссоциации зависит от ряда параметров, в том числе от концентрации, что делает её неудобной величиной для количественной
характеристики процесса диссоциации. Независящей от концентрации слабого электролита в растворе является константа диссоциации. В растворе слабого электролита (кислоты HAn или основания KtOH) устанавливается химическое равновесие: HAn «H+ + An- (1)
KtOH «Kt+ + OH- (2)
количественно характеризуемое константой диссоциации: Kа - для слабой кислоты HAn, Kb - для слабого основания KtOH.
K и a связаны между собой. Согласно закона Оствальда: для слабой кислоты 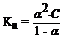 . При 1- a» 1, Ka = a2.С; для слабого основания
. При 1- a» 1, Ka = a2.С; для слабого основания  , при 1- a» 1, Kb = a2.С.
, при 1- a» 1, Kb = a2.С.
Следовательно, для одноосновной слабой кислоты: [H+] =  , [H+] = C . a.
, [H+] = C . a.
Для слабого однокислотного основания: [OH-] = 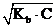 , [OH-] = C . a.
, [OH-] = C . a.
Не нашли, что искали? Воспользуйтесь поиском: