
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Образец билета тестированного контроля. по теме «Автопротолиз воды
по теме «Автопротолиз воды. Водородный и гидроксильный показатели. Гидролиз солей»
1. Укажите рН 0,01 н раствора HCl, если a = 80%:
а) 2,1 б) 11,9 в) 10-2 г) 8 . 10-3
2. Укажите рН 0,001 М раствора СН3СООН, если Kа = 1,8 . 10-5:
а) 3,87 б) 11,13 в) 1,8 . 10-3 г) 1,35 . 10-4
3. Вычислите Kгидр. фторида калия, зная, что Kа = 6,5 . 10-4:
а) 1,54 . 10-12 б) 1,54 . 10-11 в) 1,54 . 10-10 г) 1 . 10-14
4. Значения рН и характер среды в водном растворе K2CO3:
а) равна 7, нейтральная б) меньше 7, кислая
в) больше 7, щелочная г) меньше 7 щелочная
5) Выберите формулу для расчета [Н+]:
а)  б) [ОН–] в) С . a2 г)
б) [ОН–] в) С . a2 г) 
Ответы на задания образца билета ТК:
| Номер вопроса | |||||
| Код ответа | а | а | б | в | а |
ЗАНЯТИЕ 4
Тема: Буферные растворы. Гетерогенное равновесие.
Буферные растворы.
Растворы слабых кислот или слабых оснований в присутствии их солей проявляют буферное действие: рН таких растворов мало изменяется при разбавлении и при добавлении к ним небольших количеств сильной кислоты или щёлочи.
Для вычисления концентрации ионов Н+ и рН в буферных растворах слабых кислот HАn и их солей, образованных сильным основанием, применяют уравнения:
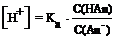 ,
, 
где pKa = - lg Ka.
Аналогично можно рассчитать концентрацию ионов ОН- и рН в буферных растворах слабых оснований (KtOH) и их солей, образованных сильной кислотой:  ,
,

Если буферный раствор состоит из средней соли (Kt2An) и кислой соли (KtHAn) двухосновной кислоты H2An, то рН вычисляется по формуле:
 , где pKa2 = - lg Ka2, показатель константы диссоциации H2An по второй ступени.
, где pKa2 = - lg Ka2, показатель константы диссоциации H2An по второй ступени.
Если буферная смесь образована кислыми солями (Kt2HАn и KtH2An) трехосновной кислоты H3An, то для расчета применяют уравнение:
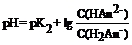
Каждый буферный раствор имеет определённую ёмкость. Число эквивалентов кислоты или щёлочи, необходимое для смещения рН 1 л буферного раствора на одну единицу, называют буферной ёмкостью:  , приV(буф.p-pa) = 1 л, в общем виде:
, приV(буф.p-pa) = 1 л, в общем виде:

где Х - формула кислоты или щёлочи.
Задачи с решениями
1. К 15 мл 0,03 М раствора НСООН добавили 15 мл 0,03 М раствора
НСООNa. Вычислите рН полученного буферного раствора. Ka=1,77 . 10-4.
 Дано:
V1 = V2 = 15 мл
C1 = C2 = 0,03 моль/л
Ka = 1,77.10-4
pН =? Дано:
V1 = V2 = 15 мл
C1 = C2 = 0,03 моль/л
Ka = 1,77.10-4
pН =?
| Решение: I вариант:
[H+] =  pH = -lg[H+]
pH = -lg[H+]
|
1) [HCOO-] в буферном растворе = 15 . 0,03/30 = 0,015 моль/л
2) [HCOOH] в буферном растворе = 15.0,03/30 = 0,015 моль/л
3) [H+] = 1,77 . 10-4. 0,015 / 0,015 = 1,77 . 10-4
4) pH = -lg1,77 . 10-4 = 4 - lg1,77 = 3,75
II вариант:
Решение задачи можно упростить, если учесть, что объём буферного раствора входит и в числитель и в знаменатель данного выражения:

Ответ: 3,75.
2. Как изменится рН буферной смеси, образованной 0,1 М раствором
СН3СООН и 0,1 М раствором СН3СООNa при добавлении: а) 0,001 М раствора HCl; б) 0,001 М раствора NaOH? Ka = 1,8 . 10-5.
Решение:
В буферной смеси 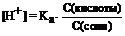 =
=  = 1,8 . 10-5,
= 1,8 . 10-5,
pH = pKa = -lg1,8  . 10-5 = 4,75.
. 10-5 = 4,75.
При добавлении соляной кислоты:
0,001 0,001 0,001
CH3COONa + HCl = CH3COOH + NaCl
[CH3COOH] = 10-1 +10-3 = 1,01 . 10-1 (моль/л)
[CH3COONa] = 10-1 -10-3 = 0,99 . 10-1 (моль/л)
[H+] =  = 1,76 . 10-5 (моль/л)
= 1,76 . 10-5 (моль/л)
При добавлении щелочи: CH3COOH + NaOH = CH3COONa + H2O
[H+] =  = 1,76 . 10-5
= 1,76 . 10-5
pH = - lg 1,76 . 10-5 = 5 - 0,24 = 4,76. Ответ: практически не меняется.
3. Рассчитайте буферную ёмкость сыворотки крови по кислоте, если на титрование 50 мл сыворотки для изменения рН от 7,4 до 7,0 было затрачено 10 мл 0,1 N раствора HCl.
| Дано: pН1 = 7,4 pH2 = 7,0 V(p-pa HCl) = 10 мл C(HCl) = 0,1 моль/л B(HCl) =? V(сыв.) = 50 мл | Решение:
 1) n(HCl) = 10.10-3.0,1=1.10-3 (моль)
2) DpH = pH1- pH2 = 7,4 - 7,0 = 0,4
B(HCl) =
1) n(HCl) = 10.10-3.0,1=1.10-3 (моль)
2) DpH = pH1- pH2 = 7,4 - 7,0 = 0,4
B(HCl) =  = 0,05 (моль/л). = 0,05 (моль/л).
|
Вопросы и задачи для самоподготовки.
1. Какие растворы (смеси) называют буферными?
2. Что называют сопряженной кислотой, сопряженным основанием? Приведите примеры протолитических реакций.
3. На какие типы делятся буферные растворы? Приведите примеры.
4. Каков механизм буферного действия на примере ацетатного буферного раствора?
5. Каков механизм буферного действия на примере аммиачного буферного раствора?
6. Как рассчитать концентрацию ионов Н+ в буферном растворе кислотного типа?
7. Как рассчитать концентрацию ионов Н+ в буферном растворе основного типа?
8. Как объяснить тот факт, что при добавлении небольших количеств сильных кислот, щелочей и разбавлении кислотность раствора практически не меняется?
9. Как рассчитываются значения рН в буферных растворах кислотного и основного типа?
10. Что понимают под а) буферной ёмкостью раствора; б) буферной силой раствора?
11. К 20 мл 1%-ного раствора NH4NO3 (r= 1 г/мл) добавили 1 мл 0,5М раствора аммиака. Раствор разбавили в мерной колбе до 100 мл. Вычислите рН полученного раствора. Kb = 1,8 . 10-5, pKb = 4,75. Ответ: 8,55.
12. К 25 мл 0,2 М раствора KH2PO4 прибавили 15 мл 0,2 М раствора K2HPO4. Вычислите рН полученного раствора. Ka1 = 7,6 . 10-3, pKa1 = 2,12; Ka2 = 6,3 . 10-8, pKa2 = 7,2; Ka3 = 1,3 . 10-12, pKa3 = 11,87. Ответ: 6,98.
13. К 12 мл 0,03 М раствора НСООН прибавили 15 мл 0,15 М раствора НСООK. Вычислите рН полученого раствора. Ka = 1,8 . 10-4, pKa = 3,75.
Ответ: 4,55.
14. Вычислите рН раствора, в 500 мл которого содержится 1 г НСООН и 1 г НСООK. Ka = 1,8 . 10-4, pKa = 3,75. Ответ: 3,49.
15. Смешали поровну 0,5%-ные растворы аммиака и нитрата аммония. Найдите рН полученного раствора, плотность которого 1 г/мл. Kb= 1,8 . 10-5, pKb = 4,75. Ответ: 9,92.
16. Сколько мл 0,2 М раствора карбоната натрия надо добавить к 10 мл 0,3 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10? Ka1 = 4,4 . 10-7, pKa1= 6,36; Ka2 = 4,7 . 10-11, pKa2 = 10,33. Ответ: 7 мл.
17. Сколько (г) Na2CO3 надо добавить к 100 мл 0,3 М раствора NaHCO3, чтобы получить раствор с рН 10? Ka1 = 4,4 . 10-7, pKa1= 6,36; Ka2 = 4,7 . 10-11, pKa2 = 10,33. Ответ: 1,49 г.
18. Сколько (в моль эквивалентов) щелочи нужно добавить к 1 мл буферного раствора, чтобы изменить рН от 7,36 до 7,50, если буферная емкость его равна 0,034 моль/л?
Гетерогенное равновесие.
В насыщенном растворе малорастворимого электролита KtAn устанавли-вается химическое равновесие: KtAn(тв) «Kt+(р-р) + An-(р-р), которое количес-твенно характеризуется при постоянной температуре константой гетерогенного равновесия, называемой произведением растворимости (ПР): ПР(KtAn) = [Kt+] . [An-]. Произведение [Kt+] . [An-] называют ионным произведением и
обозначают ИП(KtAn).
В насыщенном растворе ПР(KtAn) = ИП(KtAn), в ненасыщенном—
ПР(KtAn) > ИП(KtAn), в пересыщенном: ПР(KtAn) < ИП(KtAn).
Концентрация электролита Х в насыщенном растворе называется растворимостью (s (X) в моль/л): s (X) = L(X)/M(X), где L(X) - растворимость электролита в г/л. Связь между растворимостью и произведением растворимости электролита в зависимости от числа ионов в молекуле электролита удобно представить в виде таблицы:
Не нашли, что искали? Воспользуйтесь поиском: