
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Примером гомогенной реакции служит реакция между растворенными веществами. Примером гетерогенной реакции – реакция между твердыми и газообразными веществами
Гомогенная реакция протекает во всем объеме, гетерогенная реакция – на поверхности раздела фаз. Скорость гомогенной реакции измеряется изменением концентрации вступающего в реакцию или образующегося в результате реакции вещества в единицу времени. Обычно концентрацию выражают в моль/л, время – в секундах или минутах:
v = Δ С / Δ t,
где v – скорость химической реакции;
Δ С – изменение концентрации вещества;
Δ t – промежуток времени.
Скорость гетерогенной реакции измеряется количеством вещества, вступающего в реакцию или образующегося в ходе
реакции в единицу времени на единице поверхности раздела фаз:
v = Δ n / (S Δ t),
где S – площадь поверхности раздела фаз;
Δ n – изменение количества реагирующего вещества (в молях) соответственно в промежуток времени Δ t.
Основными факторами, определяющими скорость химических реакций, являются: природа реагирующих веществ, концентрация, температура, давление, присутствие катализатора.
Зависимость скорости реакции от концентрации выражается основным законом химической кинетики – законом действия масс: скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, соответствующие их стехиометрическим коэффициентам в уравнении реакции.
v = k ∙ [А] ∙ [В],
где v – скорость реакции;
k – коэффициент пропорциональности, называемый константой скорости реакции;
А и В − молярные концентрации реагирующих веществ.
Применяя закон действия масс к гетерогенной реакции, следует учесть, что концентрация веществ, находящихся в твердой фазе, обычно постоянна и включается в константу скорости.
Зависимость скорости реакции от температуры определяется приближенным правилом Ван Гоффа, согласно которому при повышении температуры на каждые 10 °С скорость большинства реакций увеличивается в 2 – 4 раза.
Математически эта зависимость выражается соотношением:
v (Т 2) / v (Т 1) =  ,
, 
где v (Т 2) и v (Т 1) − скорости реакций соответственно при конечной Т 2 и начальной Т 1 температурах;
γ − температурный коэффициент скорости, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10 °С.
Одним из наиболее распространенных в химической практике способов изменения скорости химических реакций является катализ. В присутствии катализатора изменяется путь, по которому проходит суммарная реакция, а поэтому изменяется ее скорость. Катализ может быть гомогенным и гетерогенным.
По признаку обратимости все химические реакции можно разделить на обратимые и необратимые.
Состояние системы, при которой скорости прямой и обратной реакций равны, называется химическим равновесием. Химическое равновесие – равновесие динамическое; непрерывно протекают две противоположно направленные реакции, концентрации же реагирующих веществ остаются неизменными.
 Для любой обратимой реакции mA + Nb pC + Qd в состоянии равновесия выполняется соотношение:
Для любой обратимой реакции mA + Nb pC + Qd в состоянии равновесия выполняется соотношение:
К = 
 ,
,
где К – константа равновесия, зависящая от температуры и природы реагирующих веществ, но не зависящая от их концентрации и присутствия катализатора.
Состояние химического равновесия существует при строго определенных условиях. При изменении одного из этих условий равновесие нарушается.
Направление смещения химического равновесия при изменении концентрации, температуры или давления определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то оно благоприятствует той из двух противоположных реакций, которая ослабляет это взаимодействие.
Так, при увеличении концентрации исходных веществ равновесие смещается в сторону образования продуктов реакции, при повышении давления – в сторону той реакции, которая сопровождается уменьшением объема системы, при повышении температуры – в сторону протекания эндотермического процесса, а понижение температуры вызовет смещение равновесия в сторону экзотермической реакции.
Задачи
1 Энергия активации некоторой химической реакции равна 50 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 320 К до 340 К?
2 Как изменяется скорость реакции:
 Н2 + I2 2 НI,
Н2 + I2 2 НI,
если увеличить давление газовой смеси в три раза?
3 Что называется константой скорости химической реакции?
4 Как изменится скорость химической реакции:
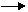 2 СО + О2 СО2,
2 СО + О2 СО2,
если уменьшить объем газовой смеси в два раза?
5 В каких единицах измеряется скорость химических реакций?
6 Как изменится скорость химической реакции:
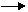 2 Н2S + О2 H2O(г) + 2 S(т),
2 Н2S + О2 H2O(г) + 2 S(т),
если уменьшить давление газовой смеси в три раза?
7 Как читается закон действия масс, когда и кем он был открыт?
8 Как возрастает скорость химической реакции при повышении температуры от 10 до 50 °С, если температурный коэффициент равен 3?
9 Как влияет на скорость химических реакций природа и состояние реагирующих веществ?
10 Как изменится скорость реакции:
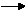 2 NO + O2 2 NO,
2 NO + O2 2 NO,
если увеличить давление в 4 раза?
11 Как зависит скорость химической реакции от температуры?
 12 Скорость реакции А + 2 В С при [А] = 0,3 моль/л
12 Скорость реакции А + 2 В С при [А] = 0,3 моль/л
и [В] = 0,4 моль/л равна 0,012 моль/л · мин. Вычислите константу скорости реакции и укажите ее размерность.
13 Что показывает температурный коэффициент скорости реакций?
14 Что такое гомогенная реакция и гетерогенная реакция? Чем они отличаются?
15 Какие реакции называются обратимыми и необратимыми?
16 В какую сторону сместится равновесие реакции:
N2 + 3 H2 = 2 NH3 + 92 кДж
а) при повышении температуры;
б) при повышении давления;
в) при увеличении концентрации азота, водорода, аммиака?
17 Что показывает константа химического равновесия? От каких факторов она зависит?
18 В какой момент при обратимых реакциях наступает равновесие?
19 Приведите примеры обратимой и необратимой реакций. Дайте характеристику химического равновесия.
20 Объясните принцип Ле Шателье.
21 Обратимая реакция протекает по уравнению:
2 NO + O2 <=> 2 NO2.
В момент равновесия концентрация всех веществ была:
а) [NO] = 0,04 моль/л;
б) [O2] = 0,02 моль/л;
в) [NO2] = 0,16 моль/л.
Вычислите исходные концентрации окиси азота и кислорода.
22 Какие вещества называются катализаторами?
23 В какую сторону сместится равновесие реакций:
а) N2O4 <=> 2 NO2 − 59,94 кДж;
б) СО + Н2О <=> СO2 + Н2 + 42,71 кДж;
в) СO2 + С(т) <=> 2СO − 160,36 кДж;
г) 2 N2 + О2 <=> 2 NO2 − 160,36 кДж
при повышении давления и понижении температуры?
24 Как влияет катализатор на скорость химической реакции?
25 Как влияет на каталитические процессы температура?
Не нашли, что искали? Воспользуйтесь поиском: