
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕОРИЯ ГИБРИДИЗАЦИИ И ТЕОРИЯ ОТТАЛКИВАНИЯ ЭЛЕКТРОННЫХ ПАР.
Теория валентных связей (метод валентных связей) — приближённый квантовохимический расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар.
Теория валентных связей заложена году В.Гайтлером и Ф.Лондоном на примере квантовохимического расчёта молекулы водорода (1927 г). В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию. Связь между атомами возникает в результате обмена неспаренными электронами при перекрывании двух атомных орбиталей разных атомов. При этом противоположные спины электронов, находящихся на атомных орбиталях исходных атомов, спариваются. Электронная пара оказывается распределенной по всему пространству молекулы с различной плотностью, причём между ядрами имеется повышенная электронная плотность по сравнению с другими областями пространства. Это сгущение электронной плотности на линии, связывающей ядра атомов, производит стягивающее действие на ядра и, соответственно, приводит к образованию химической связи (рис.1). Энергия связи определяется в основном обменным интегралом, величина которого существенно зависит от степени перекрывания атомных орбиталей атомов.

рис. 1
Представление о гибридизации атомных орбиталей занимает центральное место в теории валентных связей. Концепция гибридизации атомных орбиталей была предложена в 1931 году Л. Полингом для объяснения того факта, что при наличии у центрального атома неравноценных по исходному состоянию атомных орбиталей образующиеся связи оказываются полностью эквивалентными пространственно и энергетически. При гибридизации разные по типу и близкие по энергии орбитали «смешиваются», образуя новые по форме и направленности в пространстве гибридные орбитали. Энергии образованных гибридных орбиталей равны и являются усредненными между энергиями исходных. Название гибридным орбиталям дается по типу и числу исходных, участвующих в «смешивании»: одна s- и три p-орбитали дают четыре sp3 – гибридные орбитали, две d-, одна s- и три р-орбитали дают шесть d2sp3 – гибридных орбиталей.
Метод валентных связей позволил получить блестящие результаты в описании многих молекул (в 1954 г Лайнус Полинг был удостоен Нобелевской премии по химии), однако имел ограничения применимости (впрочем, как любой научный метод). На основе теории гибридизации была развита теория отталкивания электронных пар Гиллеспи – Найхолма. Согласно этой теории молекула принимает форму, при которой отталкивание внешних электронных пар минимально. То есть электронные пары внешнего слоя атома располагаются в пространстве так, чтобы быть максимально удаленными друг от друга. При этом не важно, является ли электронная пара неподеленной (принадлежащей только этому атому) или она является обобщенной с каким-то другим атомом, т.е. участвует в связывании. В отталкивании они ведут себя почти равноценно.
Теория гибридизации атомных орбиталей не отражает реальный физический процесс, зато позволяет наглядно объяснить геометрию многих молекул. Приведем примеры описания образования некоторых молекул методом валентных связей.
ВеCl2
Центральный атом – Ве – имеет 2 электрона на внешнем электронном уровне: 2s22p0. Чтобы образовать две связи с атомами хлора, нужно, чтобы электроны были «расспарены», это возможно при переходе атома бериллия в возбужденное состояние: 2s12p1:

Каждый атом хлора уже имеет по одному неспаренному электрону: 2s22p5:

Один неспаренный электрон атома Ве объединяется с неспаренным электроном одного атома Cl, а второй неспаренный электрон Ве – с неспаренным электроном второго атома Cl. Схематично образование химиеской связи можно изобразить так:

Чтобы рисунок не был громоздким, можно изображать только электронно-графическую формулу центрального атома, а от остальных «оставить» только неспаренные электроны, участвующие в связи (для контраста их мы изобразим более длинными стрелочками):

Поскольку в связи принимают участие одна s- и одна р- орбиталь центрального атома, тип гибридизации в получившейся молекуле – sp. Две равноценные по энергии гибридные орбитали будут располагаться в пространстве так, чтобы быть максимильно удаленными друг от друга: по прямой линии (угол 1800).Форма молекулы определяется расположением гибридных орбиталей: молекула ВеCl2 линейная.

SnCl2
Выясним, почему молекула, состоящая, так же как и молекула ВеCl2, из трех атомов, имеет не линейное, а уголковое строение (согласно экспериментальным данным). Центральный атом - олова - имеет 4 электрона на внешнем электронном уровне (IV группа) 2s22p2. Два из них не спарены, могут образовать две одинарные (σ) связи с атомами хлора:

При этом у атома олова одна пара электронов осталась неподеленной. Не забудем положение теории отталкивания электронных пар о том, что неподеленная электронная пара участвует в отталкивании наравне с другими, образующими связь. Учтем это при выводе типа гибридизации: одна s и две р – орбитали дают три гибридные sp2- орбитали. Итак, тип гибридизации - sp2; эти три орбитали располагаются на максимальном удалении друг от друга - по плоскому треугольнику, под углом 1200. Форма молекулы, однако – уголок, т.к. одна из орбиталей – это просто неподеленная пара, не «заметная» в стуктуре молекулы, но вносящая вклад в расталкивание орбиталей. Реальный угол в молекуле хлорида олова (II) меньше 1200 и равен 1000 за счет того, что неподеленная электронная пара отталкивается сильнее, чем пары, образующие связи.

Н2О
Центральный атом – кислород, имеет два неспаренных электрона для образования двух σ-связей с атомами водорода:
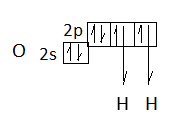
Две неподеленные электронные пары атома О участвуют в гибридизации: sp3. Орбитали располагаются по тетраэдру; форма молекулы – уголковая. Угол, в отличие от угла молекулы SnCl2, близкий к тетраэдрическому - 104027’ (меньше угла математического тетраэдра 109028’, т.к. две неподеленные пары отталкиваются сильнее).

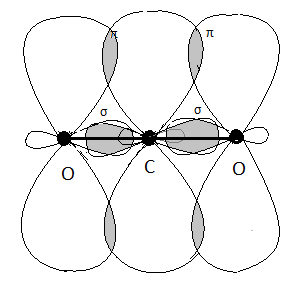
СО2
В этой молекуле, в отличие от описанных ранее, обе связи С=О – двойные. Они разного типа: первая σ, вторая – π-связь. Вспомним, что π-связь располагается над и под линией, связывающей ядра, т.е. пространственно там же, где и σ-связь, поэтому на геометрию молекулы влияние не оказывает. Орбитали, образующие π-связь, не участвуют в отталкивании самостоятельно, и не учитываются при выводе типа гибридизации.
Каждый атом кислорода имеет два неспаренных электрона и образует по две связи с четырехвалентным атомом углерода: 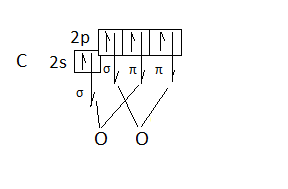
Получаем тип гибридизации sp. Орбитали располагаются по прямой линии, молекула СО2 – линейная.
Не нашли, что искали? Воспользуйтесь поиском: