
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Подбор коэффициентов в О.В.Р. методом электронного баланса
0 +5 +2 +1
Zn + HNO3 → Zn(NO3)2 + N2O + H2O
Алгоритм.
1. Определите элементы, изменившие с.о.
2. Выпишите элементы попарно.
Zn0 → Zn+2
2 N+5 → 2 N+1
3. Если с.о. возрастает, то электроны прибавляем (столько электронов вычитаем и прибавляем на сколько единиц меняется с.о.), укажите процессы.
Zn0 – 2 ē → Zn+2 – ок-е
в-ль
2 N+5 + 8 ē → 2 N+1 – в-е
ок-ль
4. Находим Н.О.К. (ē) и подбираем к ним дополнительные множители.
н.о.к. доп. множитель

 Zn0 – 2 ē → Zn+2 – ок-е х4
Zn0 – 2 ē → Zn+2 – ок-е х4
в-ль 8
2 N+5 + 8 ē → 2 N+1 – в-е х1
ок-ль
5. Суммируем левую часть схемы с левой, а правую – с правой, учитывая дополнительные множители.

 Zn0 – 2 ē → Zn+2 – ок-е х4
Zn0 – 2 ē → Zn+2 – ок-е х4
в-ль 8
2 N+5 + 8 ē → 2 N+1 – в-е х1
ок-ль 
∑ 4 Zn0 + 2 N+5 → 4 Zn+2 + 2 N+1
6. Переносим коэффициенты из баланса в схему реакции, учитывая, что HNO3 является и окислителем и солеобразователем, поэтому коэффициент перед HNO3 не переносим.
4 Zn + HNO3 → 4 Zn(NO3)2 + N2O + H2O.
7. Уравниваем число атомов в левой и правой частях схемы, начиная с металлов, затем – НеМе, Н и проверяем правильность по О.
30 = 30
4 Zn + 10 HNO3 → 4 Zn(NO3)2 + N2O + 5 H2O
Подбор коэффициентов ионно-электронным методом (метод полуреакций)
Алгоритм.
1. Составляем полное и краткое ионное уравнение, помня, что коэффициенты не подобраны.
2. Выписываем попарно частицы, изменившие свой состав или заряд.
3. Среда раствора.

 Кислая Щелочная Нейтральная
Кислая Щелочная Нейтральная
а) избыток кислорода в а) недостаток О в части- а) избыток О в частице
частице связываем иона- це берём из ионов связываем молекулами
ми (Н+) с образованием (ОН‾) с образованием воды с образованием
молекул воды; молекул воды; ионов (ОН‾);
б) недостаток О в частице б) избыток О в частице б) недостаток О в частице берём из молекул воды с связываем молекула- берём из молекул воды
образованием Н+. ми воды с образовани- с образованием ионов
ем ионов (ОН‾). (Н+).
4. Уравниваем число атомов каждого элемента в левой и правой частях схемы.
5. Находим суммарный заряд частиц.
6. Если заряд увеличивается, то электроны вычитаем; если заряд уменьшается, то электроны прибавляем (уравниваем заряды).
7. Находим Н.О.К.электронов и подбираем к ним дополнительные множители.
8. Складываем левую часть схемы с левой, а правую с правой, учитывая дополнительные множители.
9. Сокращаем одинаковые частицы в левой и правой частях.
10. Переносим коэффициенты в схему реакции (если для одного вещества два коэффициента, то переносим больший).
11. Проверяем по кислороду правильность составления уравнения.
Кислая среда
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
K++MnO4‾+2Na++SO32-+2H++SO42-→Mn2++SO42-+2Na++SO42-+2K++SO42-+H2O
MnO4‾+SO32-+2H+→Mn2++SO42-+H2O
н.о.к.
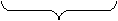
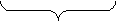

 MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O х 2 (в-ие)
MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O х 2 (в-ие)
 |  |
ок-ль 10
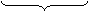
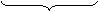 SO32- + H2O - 2 ē → SO42- + 2 H+ х 5 (ок-ие)
SO32- + H2O - 2 ē → SO42- + 2 H+ х 5 (ок-ие)

 в-ль
в-ль
6 3
2 MnO4‾ + 5 SO32- + 16 H+ + 5 H2O → 2 Mn2+ +5 SO42-+ 8 H2O + 10 H+
2 KMnO4 + 5 Na2SO3 + 3 H2SO4 → 2 MnSO4 + 5 Na2SO4 + K2SO4 + 3 H2O
Щелочная среда
KMnO4 + Na2SO3 + КОН → К2MnO4 + Na2SO4 + H2O
K+ + MnO4‾ + 2 Na+ + SO32- + К+ + ОН‾ → 2 К+ + MnO42- + 2 Na+ + SO42- + H2O
MnO4‾ + SO32- + 2 H+ → Mn2+ + SO42- + H2O
н.о.к.



 MnO4‾ + 1 ē → MnO42- х 2 (в-ие)
MnO4‾ + 1 ē → MnO42- х 2 (в-ие)
ок-ль 2
 SO32- + 2 OН‾ - 2 ē → SO42- + 2 H2О х 1 (ок-ие)
SO32- + 2 OН‾ - 2 ē → SO42- + 2 H2О х 1 (ок-ие)
 в-ль
в-ль
 |
2 MnO4‾ + SO32- + 2 ОН‾ → 2 MnO42- + SO42-+ H2O
13 = 13
2 KMnO4 + Na2SO3 + 2 KOH → 2 K2MnO4 + Na2SO4 + H2O
Нейтральная среда
KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOН
K+ + MnO4‾ + 2 Na+ + SO32- + H2O → MnO2 + 2 Na+ + SO42- + K++ OН‾
MnO4‾ + SO32- → MnO2 + SO42-
н.о.к.
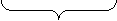

 MnO4‾ + 2 H2O + 3 ē → MnO2 + 4 OH‾ х 2 (в-ие)
MnO4‾ + 2 H2O + 3 ē → MnO2 + 4 OH‾ х 2 (в-ие)

 ок-ль 6
ок-ль 6
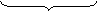
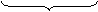 SO32- + H2O - 2 ē → SO42- + 2 H+ х 3 (ок-ие)
SO32- + H2O - 2 ē → SO42- + 2 H+ х 3 (ок-ие)

 в-ль
в-ль
 |
1 2 ОН
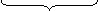 2 MnO4‾ +
2 MnO4‾ + 4 H2O + 3 SO32- + 3 H2O → 2 MnO2 + 3 SO42- + 6 H+ + 8 OH‾
18 = 18 6 HOH
2 KMnO4 + 3 Na2SO3 + H2O → 2 MnO2 + 3 Na2SO4 + 2 KOH
Расчёт Э.Д.С.
Количественной характеристикой окислительно-восстановительной способности является окислительно-восстановительный потенциал или стандартный электродный потенциал (φ˚ или Е˚В).
Чем больше значение φ˚, тем сильнее выражены окислительные свойства.
Чем меньше значение φ˚, тем сильнее выражены восстановительные свойства.
|
1. О.В.Р. возможна, если Э.Д.С. > 0.
2. Если Э.Д.С. < 0, то прямая реакция невозможна.
3. Если Э.Д.С. = 0, то в системе – химическое равновесие.
Возможна ли реакция: Mg + ZnSO4 → Zn + MgSO4?
0 +2 0 +2
Mg + ZnSO4 → Zn + MgSO4
в-ль ок-ль
φ˚Zn+2/Zn0 = - 0,76 В
φ˚Mg+2/Mg0 = - 2,37 В
Э.Д.С. = - 0,76 – (- 2,37) = 1,6 В.
Т.к. Э.Д.С. > 0, то реакция возможна.
ТЕМА 11. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ (Г.Э.)
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА (Х.И.Т.)
Г.Э. – устройство, состоящее из двух полуэлементов, в котором химическая энергия превращается в электрическую.
Полуэлемент – система, состоящая из металлической пластинки, опущенной в раствор собственной соли.
Цинковый и медный полуэлементы.
До замыкания цепи.













|
 Zn
Zn 









|
 Cu
Cu
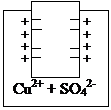 |
Zn/ZnSO4 Cu/CuSO4
Zn0 - 2ē ↔ Zn2+ (1) Cu0 - 2ē ↔ Cu2+ (2)
В обоих полуэлементах образуются электродные потенциалы, однако на цинке будет больший избыток электронов, т.к. он более активный металл, поэтому равновесие (1) в большей степени смещено вправо, чем равновесие (2).
Для замыкания цепи необходимы:
Проводник первого рода – металлическая проволока (для движения электронов по внешней цепи)
Проводник второго рода – стеклянная трубка, заполненная агар-агаром и KCl (электролитический мостик, по которому движутся анионы).
 После замыкания цепи.
После замыкания цепи.
ē




|








|
 | |||||
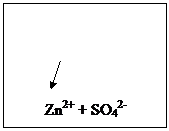 |
|
SO42-
 | |||||||||
 | |||||||||
 |  | ||||||||
 | |||||||||
ē


 _
_
(A) Zn/ ZnSO4// CuSO4/ Cu (K)
Равновесие (1) и (2) нарушатся:
 | |||
 |
(1) (А) Zn0 - 2ē → Zn2+ (K) Cu2+ + 2ē → Cu0
Выводы:
1.  Анод – электрод, на котором Катод – электрод, на котором
Анод – электрод, на котором Катод – электрод, на котором
происходит процесс окисления: происходит процесс восстановления:
Активный металл (φ<); Неактивный металл (φ>);


 Заряд, т.к. ионы Меn+ из металли – Заряд, т.к. ионы Меn+ переходят на
Заряд, т.к. ионы Меn+ из металли – Заряд, т.к. ионы Меn+ переходят на
ческой решётки переходят в раствор; электрод из неактивного металла
Процесс – Ме0 – nē → Men+ - Процесс - Меn+ + nē → Ме0 –
избыток (ē) на (А). за счёт ē, которые перешли с анода.
 |  |  |  |  | |||||









 ●
● 

 ● ●
● ●


 ●
● 

 |  | ||||
 |
2.  Расчёт ЭДС (Г.Э.)
Расчёт ЭДС (Г.Э.)
ЭДС (электродвижущая сила) – разность потенциалов.
ЭДС = φ(К) – φ(А)
ЭДС = φ0Сu2+/Cu0 – φ0Zn2+/Zn0 (н.у.) = 0,34 – (- 0,76) = 1,1 В.
Для произвольных условий по уравнению Нернста.
ЭДС = (φ0Сu2+/Cu0 + 2,31·R·T lg[Cu2+]) – (φ0Zn2+/Zn0 + 2,31·R·T lg[Zn2+])
n·F n·F
ЭДС = (φ0Сu2+/Cu0 + 0,059/2·lg[Cu2+]) – (φ0Zn2+/Zn0 + 0,059/2·lg[Zn2+])
3. Г.Э. работает до тех пор, пока не выровняются потенциалы электродов (пока идут обе реакции).
Не нашли, что искали? Воспользуйтесь поиском: