
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Используя простые соотношения
Содержание
1. Цель работы…………………………………………………………...4
2. Теоретическая часть…………………………………………………..4
3. Экспериментальная часть…………………………………………….7
4. Порядок выполнения работы………………………………………...9
4.1. Экспериментальная проверка уравнения состояния
идеального газа…………………………………………………………..9
4.2. Определение неизвестного объема сосуда……………………….11
5. Требования к отчету…………………………………………………12
6. Контрольные вопросы……………………………………………….12
Список литературы…………………………………………………..13
Лабораторная работа № 29
ИЗУЧЕНИЕ ВЗИМОСВЯЗИ ПАРМЕТРОВ
СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА И ГАЗОВЫХ ЗАКОНОВ
Цель работы
1.1. Изучение взаимосвязи макропараметров, определяющих состояние идеального газа.
1.2. Экспериментальная проверка уравнения состояния идеального газа.
1.3. Измерение неизвестного объема сосуда на основе газовых законов.
Теоретическая часть
Идеальным газом называют газ, состоящий из частиц, размеры
Которых малы по сравнению со средними расстояниями между ними и которые взаимодействуют между собой и с другими телами только при непосредственном соприкосновении, причем ведут себя при этом как абсолютно упругие шары.
Состояние, в котором находится идеальный газ, полностью задается его температурой Т, давлением Р и количеством в единице объема. Макропараметры, определяющие состояние газа, взаимосвязаны между собой, т. е. удовлетворяют уравнению, которое называют уравнением состояния идеального газа.
Сила давления идеального газа, действующая на какую-либо поверхность, с точки зрения молекулярно-кинетической теории представляет собой силу, действующую на эту поверхность со стороны частиц газа при их взаимодействии с ней. Сила  , действующая со стороны одной частицы на участок поверхности площадью S, по третьему закону Ньютона равна по модулю силе, действующей со стороны поверхности на частицу, которая, в свою очередь, по второму закону Ньютона равна скорости изменения импульса частицы в результате взаимодействия. Следовательно,
, действующая со стороны одной частицы на участок поверхности площадью S, по третьему закону Ньютона равна по модулю силе, действующей со стороны поверхности на частицу, которая, в свою очередь, по второму закону Ньютона равна скорости изменения импульса частицы в результате взаимодействия. Следовательно,
 , (2.1) где m 1–масса частицы;
, (2.1) где m 1–масса частицы;  и
и  –ее скорости до и после взаимодействия с поверхностью;
–ее скорости до и после взаимодействия с поверхностью;  – время этого взаимодействия. Поскольку оно сводится к абсолютно упругому удару, то
– время этого взаимодействия. Поскольку оно сводится к абсолютно упругому удару, то 
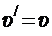 и угол, под которым частица подлетает к поверхности, равен углу, под которым она отлетает. Поэтому в системе координат, одна из осей которой перпендикулярна площадке S рис. 2.1, из (2.1) получаем:
и угол, под которым частица подлетает к поверхности, равен углу, под которым она отлетает. Поэтому в системе координат, одна из осей которой перпендикулярна площадке S рис. 2.1, из (2.1) получаем:
 , (2.2)
, (2.2)
где  – проекция скорости частицы на ось y.
– проекция скорости частицы на ось y.
 | |||
|
Если считать, что у всех частиц эта проекция одинакова, то за время Δ t c площадкой S должны столкнутся те из них, которые движутся по направлению к ней и удалены от нее на расстояние, не больше чем  . Число таких частиц N y, принимая во внимание хаотичность их движения, в среднем равно половине всех, находящихся в объеме
. Число таких частиц N y, принимая во внимание хаотичность их движения, в среднем равно половине всех, находящихся в объеме  :
:
 , (2.3)
, (2.3)
где n – концентрация частиц. При этом они будут действовать на площадку S с силой F, равной
 . (2.4)
. (2.4)
Но в действительности частицы движутся со скоростями, разными как по величине, так и по направлению, поэтому средняя сила их давления определяется средним значением квадрата скорости  на ось у, которое опять же ввиду большого числа частиц и беспорядочности их движения не должно отличаться от средних значений квадратов проекций скоростей на другие координатные оси. В итоге
на ось у, которое опять же ввиду большого числа частиц и беспорядочности их движения не должно отличаться от средних значений квадратов проекций скоростей на другие координатные оси. В итоге  и средняя сила давления газа оказывается равной:
и средняя сила давления газа оказывается равной:
 , (2.5)
, (2.5)
а его давление будет:
 . (2.6)
. (2.6)
По закону равнораспределения энергии теплового движения молекул средняя кинетическая энергия поступательного движения частицы газа равна  , где k – постоянная Больцмана. Значит:
, где k – постоянная Больцмана. Значит:
 . (2.7)
. (2.7)
Подставляя (2.7) в (2.6), получаем уравнение состояния идеального газа в виде:
 . (2.8)
. (2.8)
Используя простые соотношения
 ,
,  ,
,  ,
,  , (2.9)
, (2.9)
в которых N – число частиц газа; V – его объем; 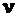 – число молей; m – масса; М – молярная масса; R – газовая постояная; NA – число Авагадро, уравнение (2.8) можно преобразовать к уравнениям:
– число молей; m – масса; М – молярная масса; R – газовая постояная; NA – число Авагадро, уравнение (2.8) можно преобразовать к уравнениям:
 ,
,
 , (2.10)
, (2.10)
 .
.
Каждое из этих уравнений является уравнением состояния идеального газа (последнее из них принято называть уравнением Менделеева-Клапейрона).
Из уравнения состояния идеального газа вытекают следующие закономерности изменения его макропараметров при переходе из одного состояния в другое. Во всех процессах с постоянным количеством газа
 const. (2.11)
const. (2.11)
Если же при этом остается неизменным еще один из параметров, то в случае изотермического процесса (Т = const)
PV = const, (2.12)
изобарного (P = const) –  const, (2.13)
const, (2.13)
а изохорного (V = const) –  const. (2.14)
const. (2.14)
Законы идеального газа вполне применимы к реальным газам при условиях, не очень сильно отличающихся от нормальных.
Не нашли, что искали? Воспользуйтесь поиском: