
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Общие методические указания. Домашняя подготовка. При изучении темы необходимо знать:
Домашняя подготовка. При изучении темы необходимо знать:
I) классификацию и номенклатуру неорганических соединений;
2) общие способы получения и химические свойства основных классов неор-ганических соединений – оксидов, гидроксидов (основных, кислотных и ам-фотерных), солей (средних, кислых, основных); 3) правила составления графических формул кислот, оснований и солей; 4) генетическую связь между классами неорганических соединений.
Таблица 2
| Номер вариан-та | Составьте формулы оксидов, гидрокси-дов, солей, докажите характер гидрокси-дов уравнениями реакций в молеку-лярном и ионном виде | Исходя из дан-ных соединений составьте форму-лы средних, кис-лых и основных солей. Назовите их.Составьте гра-фические форму-лы. | .В молекулярном и ионном виде напишите уравнения реакций с по-мощью которых можно осуществить превращения. |
| Cr+3; Pb+2; C+4 | H3PO4; Ca(OH)2 | Zn→ZnO→Na2ZnO2→Zn(OH)2→ →ZnSO4 | |
| Be+2; Na+1; C+4 | Cr(OH)3; H2SO4 | AlCl3→Al(OH)3→NaAlO2→ →Al(OH)3 | |
| Ca+2; Zn+2; S+6 | Al(OH)3; HNO3 | Al2O3→Al(NO3)3→AlOH(NO3)2→ →Al(OH)3 | |
| N+5; Al+3; Ba+2 | Ba(OH)2; HNO3 | K→KOH→KCrO2→Cr(OH)3 | |
| K+1; Cr+3; N+3 | Ca(OH)2; H2CO3 | FeCl2→Fe(OH)2→Fe(OH)3→Fe2O3→ →FeCl3 | |
| Ca+2; Be+2; Cl+7 | Al(OH)3; H2SO4 | AlCl3→Al(OH)3→NaAlO2→Al(OH)3 | |
| Al+3; N+5; Cr+6 | H2CrO4; Ba(OH)2 | ZnSO4→Zn(OH)2→Na2ZnO2→ →Zn(OH)2 | |
| S+4; Ni+2; Sn+2 | H2PbO2; Ba(OH)2 | Cr2(SO4)3→Cr(OH)3→NaCrO2→ →Cr(OH)3 | |
| Mn+7; Cr+3; K+1 | Zn(OH)2; HNO3 | Cu→CuCl2→CuOHCl→Cu(OH)2→ →CuO | |
| Si+4; Cd+2; Pb+2 | Al(OH)3; H2SO4 | Pb(NO3)2→Pb(OH)2→Na2PbO2→ →Pb(OH)2 | |
| P+5; Fe+3; Cs+1 | H2SO3;Ba(OH)2 | Na→NaOH→Na2ZnO2→Zn(OH)2 | |
| Se+6; Sr+2; Cl+1 | H3AsO4; KOH | Cr→CrCl3→Cr(OH)3→NaCrO2 | |
| Pb+4; Mn+2; W+6 | Al(OH)3; H2SO4 | Al→NaAlO2→Al(OH)3→Al2O3 | |
| Na+1; Mn+7; Cr+3 | Fe(OH)3; H2SO4 | Zn →Na2ZnO2→Zn(OH)2→Zn(NO3)2 | |
| S+6; Mg+2; Be+2 | Ba(OH)2; H2SO4 | BeSO4→Be(OH)2→K2BeO2→ →Be(OH)2 | |
| Ag+1; Sn+2; S+4 | Cr(OH)3; LiOH | CaCl2→CaCO3→CaO→Ca(OH)2 | |
| As+5; Ni+2; C+4 | Cu(OH)2; H2SO4 | Ca→Ca(OH)2→CaCO3→ →Ca(HCO3)2 | |
| Fe+2; Pb+4; Si+4 | H3AsO4; KOH | Al→NaAlO2→Al(OH)3→Al2(SO4)3 | |
| Cr+6; Hg+2; Zn+2 | Sb(OH)3; H2CrO4 | K→KOH→KCrO2→Cr(OH)3 | |
| Cr+2; Si+4; Fe+3 | Ba(OH)2; H2S | MgCl2→Mg(OH)2→MgOHCl→ →MgCl2 |
Примеры выполнения задания 1
Вопрос 1
 Nа Н2РO4
Nа Н2РO4
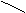 P+5 — P 2O5 — H3 РO4 — Na3РO4
P+5 — P 2O5 — H3 РO4 — Na3РO4
Nа2НРO4
P 2O5– кислотный оксид; оксид фосфора (V);
H3 РO4– кислотный гидроксид;ортофосфорная кислота;
Na 3 РO4 – средняя соль; фосфат натрия.
Nа 2 НРO4 – кислая соль; гидрофосфат натрия.
Nа H2 РO4– кислая соль; дигидрофосфат натрия
H3 РO4 + 3NaOH = Na3РO4 + 3H2O
H3 РO4 + 3OH- = 3H2O + РO4 3-
H3 РO4 + HCl = реакция не идет
Вопрос 2
Даны Zn(OH)2 и H2SO4
Zn(OH)2 – двухкислотное основание – образует два ряда солей- средние и основные. Средняя соль ZnSO4, сульфат цинка; основная соль (ZnOH)2SO4, гидроксосульфат цинка. H2SO4 – двухосновная кислота, образует два ряда солей – средние и кислые, кислая соль Zn(HSO4)2, гидросульфат цинка.


Вопрос 3 Осуществить превращения
Al→Al(NO3)3→AlOH(NO3)2→ Al(OH)3 → Al2 (SO4)
Сr(NO3)3 + Al → Al(NO3)3 + Сr
Al(NO3)3 + NaOH нед. →AlOH(NO3)2 + NaNO3
Al3+ + OH- + 2NO3- = AlOH(NO3)2
AlOH(NO3)2 +2 NaOH= Al(OH)3 + 2NaNO3
AlOH(NO3)2 + 2OH- = Al(OH)3 + 2NO3-
2Al(OH)3 +3H2SO4 = Al2 (SO4) 3 +6H2O
2Al(OH)3 + 6 H+ = 2 Al3+ + 6H2O
Задание 3. Химическая термодинамика. Кинетика и химическое равновесие
Не нашли, что искали? Воспользуйтесь поиском: