
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Температура — мера средней кинетической энергии молекул
Для того чтобы сравнить уравнение состояния идеального газа и основное уравнение молекулярно-кинетической теории, запишем их в наиболее совпадающем виде.
Уравнение состояния идеального газа 
| Основное уравнение молекулярно-кинетической теории газа 
|
Из этих соотношений видно, что:
 (1.48)
(1.48)
где
 (1.49)
(1.49)
величина, которая называется постоянной Больцмана — коэффициент, позволяющий энергию движения молекул (конечно, среднюю) выражать в единицах температуры, а не только в джоулях, как до сих пор.
Как уже говорилось, «объяснить» в физике означает установить связь нового явления, в данном случае — теплового, с уже изученным — механическим движением. Это и есть объяснение тепловых явлений. Именно с целью находить такое объяснение в настоящее время разработана целая наука — статистическая физика. Слово «статистическая» означает, что объекты исследования — это явления, в которых участвует множество частиц со случайными (у каждой частицы) свойствами. Исследование таких объектов у человеческих множеств — народов, населения — предмет статистики.
Именно статистическая физика является основой химии как науки, а не как в поваренной книге — «слейте то и то, получится, что надо!» Почему получится? Ответ в свойствах (статистических свойствах) молекул.
Отметим, что, конечно, возможно использование найденных связей энергии движения молекул с температурой газа и в другом направлении для выявления свойства самого движения молекул, вообще свойств газа. Например, ясно, что внутри газа молекулы обладают энергией:
 (1.50)
(1.50)
Эта энергия так и называется — внутренняя. Внутренняя энергия есть всегда! Даже когда тело покоится и не взаимодействует ни с какими другими телами, оно обладает внутренней энергией.
Если молекула — не «кругленький шарик», а представляет собой «гантель» (двухатомную молекулу), то кинетическая энергия представляет собой сумму энергии поступательного движения (только поступательное движение и рассматривалось фактически до сих пор) и вращательного движения (рис. 1.18).

Рис. 1.18. Вращение молекулы
Произвольное вращение можно представить себе как последовательное вращение сначала вокруг оси x, а затем вокруг оси z.
Запас энергии такого движения ничем не должен отличаться от запаса движения по прямой. Молекула «не знает» — летит она или крутится. Тогда во всех формулах необходимо вместо числа «три» ставить число «пять».
 (1.51)
(1.51)
Такие газы, как азот, кислород, воздух и т. д., нужно рассматривать именно по последним формулам.
Вообще, если для строгой фиксации молекулы в пространстве нужно i чисел (говорят «i степеней свободы»), то
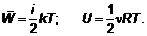 (1.52)
(1.52)
Как говорят, «по пол kT на каждую степень свободы».
1.9. Растворенное вещество
как идеальный газ
Представления об идеальном газе находят интересные приложения в объяснении осмотического давления, возникающего в растворе.
Пусть среди молекул растворителя находятся частицы какого-либо другого растворенного вещества. Как известно, частицы растворенного вещества стремятся занять весь доступный объем. Растворенное вещество расширяется совершенно так же, как расширяется газ, чтобы занять предоставленный ему объем.
Подобно тому, как газ оказывает давление на стенки сосуда, растворенное вещество оказывает давление на ту границу, которая разделяет раствор от чистого растворителя. Такое дополнительное давление называется осмотическим давлением. Это давление можно наблюдать, если отделить раствор от чистого растворителя полунепроницаемой перегородкой, через которую легко проходит растворитель, но не проходит растворенное вещество (рис. 1.19).

Рис. 1.19. Возникновение осмотического давления в отсеке с растворенным веществом
Частицы растворенного вещества стремятся раздвинуть перегородку, и если перегородка мягкая, то она выпучивается. Если же перегородка жестко закреплена, то фактически смещается уровень жидкости, уровеньраствора в отсеке с растворенным веществом повышается (см. рис. 1.19).
Подъем уровня раствора h будет продолжаться до тех пор, пока возникшее гидростатическое давление ρ gh (ρ — плотность раствора) не окажется равным осмотическому давлению. Имеется полное сходство между молекулами газа и молекулами растворенного вещества. И те, и другие находятся далеко друг от друга, и те, и другие движутся хаотически. Конечно, между молекулами растворенного вещества находится растворитель, а между молекулами газа ничего нет (вакуум), но это ведь не важно. Вакуум при выводе законов не использовался! Отсюда следует, что частицы растворенного вещества в слабом растворе ведут себя так же, как молекулы идеального газа. Иначе говоря, осмотическое давление, оказываемое растворенным веществом, равно давлению, которое производило бы это же вещество в газообразном состоянии в том же объеме и при той же температуре. Тогда получим, что осмотическое давление π пропорционально температуре и концентрации раствора (числу частиц n в единице объема).
 (1.53)
(1.53)
Этот закон называется законом Вант-Гоффа, формула (1.53) — формулой Вант-Гоффа.
Полное сходство закона Вант-Гоффа с уравнением Клапейрона–Менделеева для идеального газа очевидно.
Осмотическое давление, разумеется, не зависит от вида полупроницаемой перегородки или от рода растворителя. Любые растворы с одинаковой молярной концентрацией оказывают одинаковое осмотическое давление.
Сходство в поведении растворенного вещества и идеального газа обусловленно тем, что в разбавленном растворе частицы растворенного вещества практически не взаимодействуют между собой, как не взаимодействуют и молекулы идеального газа.
Величина осмотического давления часто довольно значительна. Например, если в литре раствора содержится 1 моль растворенного вещества, то по формуле Вант-Гоффа при комнатной температуре имеем π ≈ 24 атм.
Если растворенное вещество при растворении разлагается на ионы (диссоциируется), то по формуле Вант-Гоффа
π V = NkT (1.54)
можно определить общее число N образовавшихся частиц — ионов обоих знаков и нейтральных (недиссоциированных) частиц. И, следовательно, можно узнать степень диссоциации вещества. Ионы могут быть сольватированы, но это обстоятельство не сказывается на справедливости формулы Вант-Гоффа.
Формулу Вант-Гоффа часто используют в химии для определения молекулярных масс белков и полимеров. Для этого к растворителю объема V добавляют m грамм исследуемого вещества, измеряют давление π. Из формулы
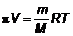 (1.55)
(1.55)
находят молекулярную массу.
Реальные газы
Окружающие нас и используемые в технологических процессах газы несколько отличаются от идеальных. Различие серьезно проявляется при давлениях в сотни атмосфер. При таких давлениях уже нельзя пренебрегать собственными объемами, занимаемыми молекулами, и их взаимодействием.
Обозначим собственный объем моля молекул данного газа b, тогда, очевидно, что в уравнении Менделеева–Клапейрона, нужно брать уже не общий объем V, а величину V — ν b, где ν — количество вещества. Такая запись показывает, что при V /ν >> b сжатие возможно свободно и газ близок по свойствам к идеальному. Если же  , то сжимаемость ограничена и реальный газ больше напоминает несжимаемую жидкость.
, то сжимаемость ограничена и реальный газ больше напоминает несжимаемую жидкость.
Также теперь нельзя полностью пренебрегать притяжением между молекулами и заменять эмпирический потенциал взаимодействия (см., например, п. 1.5.3 и рис. 1.10 и 1.11) на потенциал взаимодействия твердых шаров (см. рис. 1.12). Уравнение состояния идеального газа при этом берется как первое приближение разложения давления р по плотности (p =ρ RT / M) или по обратным степеням объема одного моля газа ((V /ν)–1). К уравнению при этом добавляется слагаемое второго порядка, пропорциональное ρ2или (V /ν)–2. Сила взаимного притяжения молекул проявляется в дополнительном давлении а (V /ν)–2, где а — постоянная, зависящая от природы газа.
Оказывается, эти соображения позволяют найти формулу уравнения состояния, дающую правильные результаты в двух предельных случаях: идеальный газ и несжимаемая жидкость. Имеем:
 (1.56)
(1.56)
Это уравнение Ван-дер-Ваальса.
Также как и для идеального газа (см. п. 1.8), зная уравнениесостояния (теперь это уравнение Ван-дер-Ваальса), можно записать выражение для внутренней энергии реального газа:
 (1.57)
(1.57)
где U ид = (i /2)ν RT — внутренняя энергия идеального газа(напоминаем, что i — число степеней свободы).
По уравнению состояния реального газа (формуле Ван-дер-Ваальса), можно найти:
 (1.58)
(1.58)
Легко построить графики изотерм реального газа в осях p–V. Они представлены на рис. 1.20. Это кривые 1 – 1 ʹ, 2 – 2 ʹ,..., 6 – 6 ʹ. Изотермы проведены при температурах: T 1< T 2<... < T 6.

Рис. 1.20. Фазовая диаграмма перехода «жидкость—газ». Объяснения приведены в тексте
Вдали от изображенной пунктиром кривой AKB эти изотермы совпадают с опытными (экспериментальными) данными. Справа — хорошо известные изотермы идеального газа, проведенные в соответствии с законом Бойля–Мариотта, pV = const; слева — вертикальные линии, проведенные в соответствии с представлениями о несжимаемой жидкости, V = const. Вблизи от кривой AKB, и особенно внутри нее, изотермы, проведенные в соответствии с формулой (1.58), ничего общего с результатами экспериментов не имеют. Равновесный переход «газ—жидкость» происходит при постоянном давлении p = const. Соответствующие горизонтальные линии изображены на рис. 1.20 пунктиром. Таким образом, в осях p – V удобно изображать фазовый переход, например «газ—жидкость», и поэтому зависимость p–V называется фазовой диаграммой.
Интересно, что изотермы, построенные при температурах Т ≥ Т 4 = Т кр, показывают, что при температурах Т > Т крневозможно превратить газ в жидкость, невозможно сжижение газов. Сама точка K с характеристиками Т кр, V кр, р крсоответствует критическому состоянию вещества.
Величины T кр, V кри р крявляются характерными величинами температуры, объема и давления для данного газа. Введение безразмерных характеристик Т ʹ = Т / Т кр, V ´= V / V кри р ʹ = р / р крпозволяет исключить характеристики вещества а, b и ν из уравнений и записать уравнение Ван-дер-Ваальса в виде:
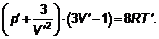 (1.59)
(1.59)
Это уравнение состояния для всех тел, к которым вообще применимо уравнение Ван-дер-Ваальса. Состояния любых тел, в которых они имеют одинаковыми любую пару параметров Т ʹ, V ʹ, р ʹ, называются соответственными состояниями. Очевидно, что если два параметра в соответственных состояниях одинаковы, то третий параметр также будет одинаков при любом уравнении состояния. Это утверждение называется законом соответственных состояний.
Применение закона соответственных состояний позволяет переносить, моделировать, интерпретировать результаты действия лекарств, полученные при одних условиях, например на лабораторных животных, на другие условия, например на человека.
Главное в главе 1
Уравнение состояния идеального газа (часто называемое в России уравнением Менделеева–Клапейрона)
 (1.21)
(1.21)
хорошо известно из школьного курса физики.
Рассмотрены изотермический, изобарный, изохорный процессы в идеальном газе. Результаты приведены в табл. 6.1.
Изложена теория осмотического давления.
С использованием основных положений молекулярно-кинетической теории (МКТ):
1) вещество состоит из частиц;
2) эти частицы непрерывно и хаотически движутся;
3) частицы взаимодействуют между собой,
рассмотрены основы строения твердых, жидких и газообразных тел.
Для идеального газа на основе положений МКТ построено основное уравнение МКТ идеального газа:
 (1.47)
(1.47)
Сравнение приведенных двух уравнений, описывающих один и тот же объект — идеальный газ, позволяет связать макроскопические характеристики газа с микроскопическими характеристиками отдельной молекулы. Средняя кинетическая энергия молекулы связывается с температурой газа
 (1.48)
(1.48)
где k = R / NА называется постоянной Больцмана.
Не нашли, что искали? Воспользуйтесь поиском: