
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Методы исследования поверхностного натяжения жидкости
Существует много способов определения коэффициента поверхностного натяжения жидкости σ. В условиях аптеки чаще всего используют метод отрыва капель (рис. 5.2).

Рис. 5.2. К расчету коэффициента поверхностного натяжения методом отрыва капель
Очевидно, что в момент отрыва капли сила поверхностного натяжения F = 2π R σ равна силе тяжести m 1 g. В прибор заливается заданный объем жидкости V. Масса одной капли m 1 = ρ V / n, где ρ — известная плотность жидкости, а n — число упавших капель, которое и подсчитывается. Измерение производится путем сравнения неизвестной жидкости с параметрами σ, ρ, n с известной жидкостью, характеризуемой величинами σ0, ρ0, n 0. Основное допущение при расчетах состоит в том, что радиус шейки капли R считают равным радиусу трубки (капилляра) r.
Найдем:
 (5.4)
(5.4)
Адсорбция
Адсорбцией называется явление сгущения газообразного или растворенного вещества на поверхности раздела фаз. Подробно адсорбция изучается в курсе коллоидной химии. Здесь будут изложены лишь элементы соответствующих представлений.
Начнем с определений. Более плотная фаза (жидкость или твердое тело, на поверхности которых происходит адсорбция) называется адсорбентом. Менее плотная фаза (газ, растворенное вещество, которое адсорбируется на поверхности адсорбента) называется адсорбтивом. Адсорбент с адсорбированным на нем адсорбтивом называется адсорбатом.
Весьма грубо силы, действующие между молекулами адсорбтива и поверхностью адсорбента, можно разделить на силы Ван-дер-Ваальсовы (слабые) и силы химические (сильные). Ван-дер-Ваальсовым силам соответствуют энергии типа потенциальной энергии Леннард–Джонса, а химическим силам — энергии химической связи.
Важнейшей характеристикой адсорбции является поверхностная концентрация адсорбтива α — количество адсорбтива (адсорбированного вещества), приходящееся на единицу площади поверхности адсорбента α = ν/ S; [α] = моль/м2.
Простейшая теория адсорбции была создана Ирвингом Ленгмюром. Эта теория основана на представлении о существовании на поверхности адсорбента «активных центров». Активными центрами называются малые области на поверхности, такие, что молекулы адсорбента из этих областей легче связываются с молекулами адсорбтива. Конечно, в таком определении часто бывает элемент тавтологии. Действительно, на вопрос: «Что такое эти малые области?» ответ будет: «Это активные центры». Сам Ленгмюр представлял, что активные центры — это возвышенности, пики на адсорбирующей поверхности. С примитивной точки зрения в активных центрах усиливается электрическое поле, сгущаются линии напряженности вокруг острия.
Представление об активных центрах приводит к заключению, что α ≤ αmax, где αmax — поверхностная концентрация адсорбтива, при которой все активные центры заняты. С другой стороны, если считать, что с одним активным центром связывается одна молекула адсорбтива (мономолекулярная теория адсорбции), то α определяется давлением (парциальным давлением) р. Ведь именно давление в идеальном газе определяется числом молекул, пришедших (столкнувшихся) к поверхности в единицу времени.
В результате Ленгмюр предложил уравнение изотермы адсорбции в виде (закон Ленгмюра):
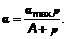 (5.5)
(5.5)
Величина 1/ А называется константой равновесия. Само А и, соответственно, 1/ А не зависят от поверхностной концентрации α.
Не нашли, что искали? Воспользуйтесь поиском: