
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Энергия Гиббса и состояние химического равновесия
Для реакции АВ(г) «А(г) + В(г) энтропийно выгодным будет процесс распада АВ(г) на компоненты  , а энергетически выгодным является обратный процесс, который сопровождается понижением энтальпии химической системы
, а энергетически выгодным является обратный процесс, который сопровождается понижением энтальпии химической системы  , т.е. выделением теплоты. На каждую из этих противоположных тенденций влияют и природа веществ, и условия проведения реакции.
, т.е. выделением теплоты. На каждую из этих противоположных тенденций влияют и природа веществ, и условия проведения реакции.
Учитывает эти противоположные тенденции предложенная американским физико - химиком Д. Гиббсом функция состояния, которая называется энергией Гиббса:
| G = H – TS | (18) |
 G = G =  H – T H – T  S S
| (19) |
В этом уравнении произведение энтропии и температуры (TDS) определяет величину “связанной” энергии, т.е. ту часть энергии (энтальпии) системы, которую невозможно перевести в работу. Тогда разница между «энергосодержанием» системы (Н) и «связанной» энергией дает долю энергии, которую можно в принципе перевести в работу. Таким образом, э нергия Гиббса определяет работоспособность системы. При обратимом и изотермическом проведении процесса DG равно по абсолютной величине, но обратно по знаку максимальной полезной работе (Аmax), которую система может произвести в данном процессе:
D GР = - Аmax.
Использование энергии Гиббса позволяет однозначно определить направление самопроизвольных процессов, происходящих в системе.
Возможен только самопроизвольный переход системы из состояния с большей энергией Гиббса в состояние с меньшей энергией Гиббса. Это другая, более общая формулировка второго закона термодинамики).
Таким образом, критерием самопроизвольного протекания процесса при изобарно-изотермических условиях является неравенство DGР < 0, справедливое для любых систем. В любой самопроизвольной реакции происходит превращение исходных веществ, имеющих некоторую величину энергии Гиббса, в продукты, имеющие меньшую ее величину.
Заметим, что полученный ранее критерий для изолированных систем DS > 0 является частным случаем: эти системы не обмениваются энергией с окружающей средой, поэтому для них D H = 0 и DG < 0, только тогда, когда DS > 0.
Если при переходе из одного состояния в другое энтропия системы не изменяется (DS = 0), то фактором, определяющим направление реакции, будет изменение энтальпии: уменьшение энтальпии (DH < 0) соответствует уменьшению энергии Гиббса (DG < 0). В этом случае протекает реакция, идущая с выделением теплоты.
Для любых реакций из уравнения DG = D H - TDS следует:
1) если DH < 0 и DS > 0, то всегда DG < 0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любой температуре;
2) если DH > 0 и DS < 0, то всегда DG > 0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
Во всех остальных случаях (DH < 0, DS < 0 и DH > 0, DS > 0) знак DG зависит от соотношения членов D H и TDS.
3) если DH < 0, DS < 0; в этом случае DG < 0 при  , т.е. реакция возможна при сравнительно низкой температуре. При низкой температуре значение Т невелико, значит, величина произведения TDS также невелика, и обычно абсолютное значение DH превосходит абсолютное значение TDS. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком DH;
, т.е. реакция возможна при сравнительно низкой температуре. При низкой температуре значение Т невелико, значит, величина произведения TDS также невелика, и обычно абсолютное значение DH превосходит абсолютное значение TDS. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком DH;
4) если DH > 0, DS > 0; тогда DG < 0 при  , процесс возможен при сравнительно высокой температуре. В этом случае направление реакции определяется знаком DS (поэтому даже реакции с поглощением теплоты (DH > 0) при DS > 0 становятся самопроизвольными);
, процесс возможен при сравнительно высокой температуре. В этом случае направление реакции определяется знаком DS (поэтому даже реакции с поглощением теплоты (DH > 0) при DS > 0 становятся самопроизвольными);
5) при равенстве DG=0 в системе устанавливается термодинамическое равновесие, которое может смещаться в любую сторону при изменении внешних факторов (температура, давление, концентрации реагирующих веществ).
Знак DG указывает на направление реакции. При DG < 0 реакция протекает в прямом направлении, при DG > 0 возможен лишь обратный процесс. При DG = 0 все вещества находятся в химическом равновесии и внешне незаметно никаких изменений и процессов в системе.
При фазовых переходах
 ,
,
исходя из этого, получается уравнение:  .
.
Величина энергии Гиббса вещества зависит как от природы этого вещества, так и от его количества. В соответствии с уравнением (18) при условиях отличных от стандартных, при парциальном давлении вещества А равном рА (рА  1 атм):
1 атм):
 .
.
Величина 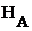 слабо зависит от давления, и при всех значениях р может быть принята равной стандартной величине. Зависимость энтропии вещества от давления выражается уравнением (13), подставив выражение (13) в (18), получим:
слабо зависит от давления, и при всех значениях р может быть принята равной стандартной величине. Зависимость энтропии вещества от давления выражается уравнением (13), подставив выражение (13) в (18), получим:

 .
.
Так как 
то для n молей вещества А получим:
GA = (GoA + RTlnpA)nA, (20)
где GA – энергия Гиббса образования вещества А при его парциальном давлении рА (pА¹1атм);
GoA - энергия Гиббса образования 1 моль вещества А при стандартных условиях (рА = 1 атм и Т = 298 К), это стандартная величина, значения которой сведены в таблицы;
nA – число молей вещества А.
Стандартная энергия Гиббса образования вещества DGо298 – изменение энергии Гиббса в реакции образования 1моль вещества из простых веществ, находящихся в устойчивых состояниях при стандартных условиях (р = 101,3 кПа и Т = 298 К).
Значения DGо298 для некоторых веществ приводятся в справочной литературе, размерность DGо298 – кДж/моль.
Стандартные энергии Гиббса образования простых веществ, находящихся в стандартном состоянии в устойчивой модификации, равны нулю. Например, DGо298, Н2(газ) = 0.
Энергия Гиббса химических реакций. В изобарно-изотермических условиях (т.е. при постоянных давлении и температуре) изменение энергии Гиббса в реакции
аА + bВ = сС + dD
запишется как
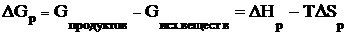 .
.
В этом уравнении
 ,
,
 ,
,
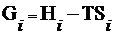 ,
,
где  ,
,  и
и  - мольные энергия Гиббса, энтальпия и энтропия соответствующего вещества при данных условиях.
- мольные энергия Гиббса, энтальпия и энтропия соответствующего вещества при данных условиях.
Изменение энергии Гиббса химической реакции при стандартных условиях (р =101,3 кПа и Т =298 К) можно вычислить по уравнению:
DGо298, реакции = DHо 298, реакции – TDSо298, реакции, (21)
где DHо298,реакции, DSо298,реакции – стандартные изменения энтальпии и энтропии химической реакции, соответственно в кДж и Дж/К;
Т - стандартная температура, равная 298 К.
Поскольку энергия Гиббса является функцией состояния, то ее значение не зависит от пути протекания процесса, а зависит только от исходного и конечного состояний системы. Изменение энергии Гиббса при стандартных условиях (DGо298, реакции) можно рассчитать, используя стандартные значения энергий Гиббса образования исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
DGо298, реакции =  DGо298, продуктов реакции -
DGо298, продуктов реакции -  DGо298, исходных веществ. (22).
DGо298, исходных веществ. (22).
Изменение энергии Гиббса DGТ для реакции, протекающей при температуре, отличной от стандартной (Т  298К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (DHореак.) и энтропии (DSореак.) реакции, и пренебрегая их зависимостью от температуры:
298К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (DHореак.) и энтропии (DSореак.) реакции, и пренебрегая их зависимостью от температуры:
DGТ = DHореакции – TDSореакции. (23)
Не нашли, что искали? Воспользуйтесь поиском: