
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Примеры решения задач. Пример 1. При сгорании 1 кг метана выделилось 50137,5 кДж теплоты
Пример 1. При сгорании 1 кг метана выделилось 50137,5 кДж теплоты. Рассчитать стандартную энтальпию образования метана НоСН4. 
Решение.
1. Переведем количество участвующего в реакции метана, выраженное в граммах, в моли (учитывая, что молярная масса СН4 равна 16 г/моль):
Количество СН4в молях n СН4равно:
n СН4=  = 62,5 моль.
= 62,5 моль.
2. Рассчитаем количество теплоты, выделяющееся при сгорании 1 моля метана:

3. Запишем термохимическое уравнение реакции горения метана:
CH4(г)+ 2О2(г) = CО2(г) + 2Н2О(г), QР = 802,2 кДж,
Нор = - QР.
Нореакции= (НоСО2+ 2 НоН2О) - (НоСН4+ 2 НоО2) =
= [(-393,5) + 2(-241,8) - (НоСН4) - 2(0)] кДж = - 802,2 кДж.
Отсюда: НоСН4= (802,2 - 393,5 - 483,6) = - 74,9 кДж/моль СН4.
Пример 2. Рассчитать количество теплоты, которое выделится при полном сгорании 100 л этана, взятого в газообразном состоянии при н.у., если в результате реакции образуется СО2(Г) и Н2О(Г).
Решение.
1. Реакция горения этана выражается термохимическим уравнением:
С2Н6(г) + З,5O2(г) = 2CO2(г) + 3Н2О(г); DНр= -1559,87 кДж.
2. Переведем количество участвующего в реакции этана, выраженное в литрах (н.у.), в моли (учитывая, что 1 моль газа при н.у. занимает объем, равный 22,4 л):
Количество этана в молях  равно:
равно:
 =
=  = 4,46 моль.
= 4,46 моль.
3. Находим значения стандартных энтальпий образования (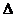 Но298) для всех веществ, участвующих в реакции (см. Приложение, табл. 2,3) и рассчитываем тепловой эффект в расчете на один моль С2Н6(Г):
Но298) для всех веществ, участвующих в реакции (см. Приложение, табл. 2,3) и рассчитываем тепловой эффект в расчете на один моль С2Н6(Г):
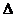 Нореакции =
Нореакции =  = [2(-393,5) + 3(-241,8)] – [-84,7 + 3,5×0] = - 1427,7 кДж/моль С2Н6(Г).
= [2(-393,5) + 3(-241,8)] – [-84,7 + 3,5×0] = - 1427,7 кДж/моль С2Н6(Г).
QP = - 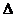 Нореакции = 1427,7 кДж.
Нореакции = 1427,7 кДж.
4. Пересчитаем полученный тепловой эффект на реальное количество этана, т.е. на 4,46 моля (100 л, н.у.):
QP = - 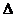 Нореальн. = 1427,7 × 4,46 = 5767,42 кДж
Нореальн. = 1427,7 × 4,46 = 5767,42 кДж
Пример 3. Не производя вычислений, определить знак изменения энтропии в следующих реакциях. Рассчитать изменение энтропии для стандартных условий и сравнить с результатом оценки.
2NН3(г) = N2(г) + 3H2(г) (1) NH4NO3(тв) = N2O(г) + 2Н2О(г) (2)
2Н2(г) + O2(г) = 2Н2O(г) (3)
2Н2(г) + O2(г) = 2Н2O(ж) (4)
Решение. В первой реакции из 2-х молей вещества, находящегося в газообразном состоянии образуется 4 моля веществ, находящихся в газообразном состоянии, следовательно, S1> 0. Изменение энтропии этой реакции в стандартных условиях (Sо298) равно:
Sо298= SоN2(Г)+ 3SоН2(г) - 2SоNН3(г) =191,5+ 3×130,5 -2×192,7=197,6 Дж/К.
Во второй реакции 1 моль вещества в твердом состоянии образует 3 моля газообразных веществ, следовательно, S2>0. Изменение энтропии этой реакции в стандартных условиях (Sо298) равно:
Sо298=SоN2О(г)+2SоН2О(г) –SоNН4NO3(тв)=219,8 + 2×188,7–151= 446,2 Дж/К.
В (3) и (4) реакциях уменьшается как общее число молей, так и число молей газообразных веществ, так что S3<0 и DS4< 0, при этом DS4 имеет более отрицательное значение, т.е. больше по абсолютной величине чем DS3, так как SН2О(г) > SН2О(ж).
Пример 4. Установить возможность восстановления диоксида титана до свободного металла по следующей реакции при стандартных условиях и при 2500К (зависимостью Hори DSорот температуры пренебречь):
TiO2(тв) + 2С(тв) = Ti(тв) + 2СО(г).
Решение. Из второго закона термодинамики следует, что самопроизвольно протекают только такие реакции, которые сопровождаются уменьшением энергии Гиббса (Gр < 0).
1. Рассчитаем Gор для стандартных условий с учетом данных приложения (табл. 2):
Gорекции= SGопродуктов – SGоисходных веществ
Gор= (2GоСО(г) + GоTi(тв)) – (GoTiO2(тв) + 2GoС(тв)) =
= [2(- 137,1) + 0] – [(- 888,6) – 2 × 0] = 614,4 кДж.
Поскольку Gор> 0, реакция при 298 К невозможна.
2. Рассчитаем изменение энергии Гиббса этой реакции для 2500 К, для чего воспользуемся уравнением:
Gр= Hоp- TSоp.
Находим изменение энтальпии реакции при стандартных условиях Hор:
Hоpеакции = (2HоСО(г) + НоTi(тв)) – (НоTiO2(тв) + 2НоС(тв)) =
= [2(- 110,5) + 0] – [(- 943,9) –2 × 0 ] = 722,9 кДж = 722900 Дж.
Аналогично вычисляем Sоp:
Sоpеакции = (2SоСО(г) + SоTi(тв)) – (SоTiO2(тв) + 2SоС(тв)) =
= [ 2 × 197,5 + 30,6] – [50,3 –2 × 5,7 ] = 363,9 Дж/К.
G2500 = Hор - TSор = 722900 – 2500 × 363,9 = -186850 Дж.
G2500 = -186,85 кДж.
Поскольку G2500< 0, то реакция при 2500 К возможна.
Пример 5. Определить константу равновесия реакции поглощения углекислого газа негашеной известью при температуре 227 оС и давлении 1 атм.
Решение:
1.Запишем уравнение реакции:
СаО(тв)+СО2(г)= СаСО3(тв).
2.Определим изменение энтальпии для этой реакции:
Hoр= HoСаСО3(тв)- HoСаО(тв) +HoСО2(г)=
=1208,5 - (636,4) - (-393,5) = -178,6 кДж/моль.
3.Определим изменение энтропии:
Soр= SoСаСО3(тв)- SoСаО(тв) +SoСО3(г)=
=88,8 - 39,8 - 213,7 = -164,7 Дж/моль.К.
4.Найдем константу равновесия (при этом Hoрнеобходимо выразить в джоулях а температуру в Кельвинах).
lgKp=  =
=  = 10.
= 10.
Kp= 1010.
Пример 6. Определить растворимость поваренной соли в воде при 60 оС.
Решение:
1.Поваренная соль, как и все соли, является сильным электролитом, т.е., растворяясь, она диссоциирует на ионы:
NaCl(тв) Na++ Cl-.
Если х молей соли перешло в раствор, то при этом образовалось х молей каждого из ионов. Поскольку концентрация твердого вещества не входит в выражение зависимости константы равновесия от концентрации реагирующих веществ, то для этой реакции эта зависимость запишется как:
Кс= [Na+] [CL-] = x.x = x2.
Отсюда растворимость х будет равна:
x =  .
.
2.Определим Кс.
Нор= НоNa+ + НоCl- - НоNaCl=
= (-240,3) + (-167,07) - (-412,0) = 4,7 кДж/моль
Sор= SNa+ + SоCl- - SоNaCl=
58,41 + 56,74 - 72,13 = 43,02 Дж/моль.К.
lgKñ=  =
=  = 1,51.
= 1,51.
Kñ= 32,4.
Растворимость х =  =
=  = 5,7 моль/л. (Фактическая растворимость 5,4 моль/л).
= 5,7 моль/л. (Фактическая растворимость 5,4 моль/л).
Пример 7. Рассчитать, сколько молей аммиака образуется при достижении химического равновесия, если в при 700 К в реактор емкостью 10 литров, закачать 10 молей водорода и 10 молей азота. Влиянием изменения давления на химическое равновесие пренебречь.
Решение:
1.Начальные концентрации водорода и азота равны 1 моль/л.
2.Рассчитаем константу равновесия (Kð) по изменению энтальпии и энтропии реакции:
N2+ 3H2 2 NH3.
Нор= -91,88 кДж/моль. Soр= -197,94 Дж/моль.К
lgKð=  = -4,15; Kð= 7,1.10-5.
= -4,15; Kð= 7,1.10-5.
3.Рассчитаем Kñ.
а = 1+3 = 4; б = 2.
Kñ = Kð /(RT)б-а = Kð /(RT)2-4= Kð /(RT)-2= Kð.(RT)2
Kñ =.7,1.10-5(0,082.700)2= 0,233.
4. Выразим Kñ через равновесные концентрации реагирующих веществ.
К моменту равновесия прореагировало х молей и в реакторе осталось (10-х) молей азота. Водорода прореагировало 3х молей и в реакторе осталось (10-3х) молей; соответственно, образовалось 2х молей аммиака. Так как объем реактора равен 10 л, то равновесные концентрации всех реагирующих веществ равны:
[N2] =  ; [H2] =
; [H2] =  ; [NH3] =
; [NH3] =  .
.
Kc=  = 0,233.
= 0,233.
 = 0,00233.
= 0,00233.
5.Определим х графическим методом, как показано в приложении 8. Для этого определим интервал допустимых значений х. В рассматриваемом случае для N2:10х0 è äëÿ H2:103х0, следовательно: 10/3х0.
P = 
По полученным данным х и Р строим таблицу и график.
| X | 1,1 | 1,2 | 1,3 | ||
| P | 5,15 | 0,0013 | 0,0018 | 0,0025 | 0,0344 |

Из графика определяем х=1,18. Таким образом до достижения равновесия в системе образуется 2х=2,36 молей аммиака и равновесная концентрация его будет равна 0,236 моль/л.
Пример 8. В реактор объемом 1 литр при температуре 1000 К закачали 1 моль SO2и 2 моля О2. В системе устанавливается равновесие:
2 SO2+ O2 2SO3.
Определить сколько теплоты выделится к моменту установления равновесия и равновесные концентрации каждого из реагирующих веществ. Влиянием изменения давления пренебречь.
Решение:
1.Рассчитаем константу равновесия (Kð) по изменению энтальпии и энтропии реакции.
Нор= -198 кДж/моль. Soр= -187 Дж/моль.К
lgKp=  = +0,6; Kp= 4.
= +0,6; Kp= 4.
2.Рассчитаем Kc.
а = 2+1 = 3; б = 2.
Kc = Kp/(RT)б-а = Kp/(RT)2-3= Kp/(RT)-1= Kp.(RT)
Kc = 4.0,082.1000 = 328.
3.Выразим Kc через равновесные концентрации реагирующих веществ (учитывая то, что объем реактора - 1 л).
К моменту равновесия прореагировало х молей и в реакторе осталось (2-х) молей кислорода. SO2прореагировало 2х молей и в реакторе осталось (1-2х) молей; соответственно, образовалось 2х молей SO3. Так как объем реактора равен 1 л, то равновесные концентрации всех реагирующих веществ равны:
[SO2] = 1-2x; [O2] = x; [SO3] = 2x.
Kc=  =328.
=328.
4.Находим значение х.
Решение уравнений высоких степеней осуществляется графическим способом, если известно, что только один корень уравнения является действительным и известен интервал его значений. В рассматриваемом случае для SO2:12х0, а для O2:2х0, следовательно: 0,5х0.
В пределах найденного интервала задаем значения х и рассчитываем значение Р, где:
P =  .
.
Значения х стараемся выбрать так, чтобы величина Р была несколько больше и меньше истинного значения Kc= 328. Результаты представим в виде таблицы.
| x | 0,4 | 0,3 | 0,45 | 0,47 | 0,48 | 0,485 | 0,475 |
| P | 1,32 |
Четыре последние значения Р наиболее близки к величине Kc, по этим значениям строим график зависимости Р от х.

Из полученного графика находим значение х соответствующее Kc= 328: x = 0,478.
5.Химическое равновесие в данной системе установилось при следующих равновесных концентрациях реагирующих веществ: [SO2] = 1-2x = 1-2.0,478 = 1,044 моль/л;
[O2] = x = 0,478 моль/л;
[SO3] = 2x = 2.0,478 = 0,956 моль/л.
6.Тепловой эффект химической реакции равен изменению энтальпии с обратным знаком: Q = -Hop= 198 кДж/моль. Поскольку до установления равновесия образовалось не 2 моля SO3а 2x = 0,956 молей, мы можем составить пропорцию:
2 моля SO3 - 198 кДж
0,956 - Q
Q = 94,7 кДж.
Не нашли, что искали? Воспользуйтесь поиском: