
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Внутренняя энергия тела
Внутренняя энергия представляет собой полный запас энергии тела и состоит из энергии поступательного и вращательного движения молекул, энергии внутримолекулярных колебаний, потенциальной энергии сил сцепления между молекулами, внутримолекулярной энергии, внутриатомной энергии.
Внутренняя энергия U является функцией состояния, она не зависит от пути процесса, а ее элементарное изменение обозначается символом полного дифференциала (dU).
Внутренняя энергия измеряется в Джоулях (Дж), а удельная внутренняя энергия (u) - в Дж/кг.
Для простых тел внутренняя энергия определяется как функция двух переменных (р,T; р,v или T,v).
Теплота
Теплота - количество энергии, передаваемой от одного тела к другому посредством теплопроводности, конвективного или лучистого теплообмена. Процесс передачи теплоты называется теплообменом.
Количество теплоты  ,получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом (
,получаемое телом в результате теплообмена, зависит от вида термодинамического процесса и аналогично работе является функцией процесса. Поэтому, элементарное количество теплоты не является полным дифференциалом ( ).
).
Количество теплоты  измеряется в Джоулях (Дж), а удельное количество теплоты
измеряется в Джоулях (Дж), а удельное количество теплоты  =
=  /
/  в Дж/кг.
в Дж/кг.
Теплоемкость
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают массовую теплоемкость с, измеряемую в Дж/(кг×К), молярную  – Дж/(кмоль×К) и объемную с' – Дж/(м3×К).
– Дж/(кмоль×К) и объемную с' – Дж/(м3×К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
 ;
;  . (18)
. (18)
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием
z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
 . (19)
. (19)
Эта теплоемкость называется истинной.
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из уравнения (19) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
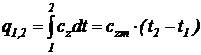 . (20)
. (20)
Отсюда следует выражение средней теплоемкости газа
 . (21)
. (21)
Для большинства газов значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону
 . (22)
. (22)
Подставив это выражение (22) в уравнение (21), получим
 , (23)
, (23)
где сzm называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
Не нашли, что искали? Воспользуйтесь поиском: