
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Кинетика – учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ΔG  <0.Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ΔG
<0.Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ΔG  (H2O(г))= -228,59 кДж/моль, а ΔG
(H2O(г))= -228,59 кДж/моль, а ΔG  (AlI3(к)) = -313,8 кДж/моль и, следовательно, при Т = 298 К и Р = 101,325 кПа возможны реакции, идущие по уравнениям:
(AlI3(к)) = -313,8 кДж/моль и, следовательно, при Т = 298 К и Р = 101,325 кПа возможны реакции, идущие по уравнениям:
Н2(г) + ½О2(г) = Н2О(г),
2Аl(к) + 3I2(к) = 2АlI3(к).
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины – для первой и воды – для второй). Катализатор как бы снимает кинетический «тормоз», и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых - концентрация (давление) реагентов, температура и действие катализатора. Эти факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Как изменятся скорости прямой и обратной реакций в системе 2SО2(г) + О2(г) ↔ 2SО3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение.
Обозначим концентрации реагирующих веществ:
[SO2] = а, [O2] = b, [SO3] = c. Согласно закону действия масс скорости и прямой и обратной реакций до изменения объема можно рассчитать по уравнениям:
Vпр = k ∙a2·b;
Vобр = k1 ∙с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3a, [O2] = 3b, [SO3] = 3с
При новых концентрациях скорости V’ прямой и обратной реакции рассчитывается по формулам
V'пр = k·(3a)2·(3b) = 27·k·a2·b;
V'обр= k1·(3с)2 = 9·k1·с2.
Отсюда


Следовательно, скорость прямой реакции увеличится в 27 раз, а обратной – только в 9 раз. Равновесие системы сместится в сторону образования серного ангидрида (SO3).
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение.
Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле


Следовательно, скорость реакции Vt2, протекающей при температуре 70оС, увеличится по сравнению со скоростью реакции Vt1, протекающей при температуре 30оС, в 16 раз.
Пример 3. Константа равновесия гомогенной системы
СО(г) + Н2О(г) ↔ СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: ССО = 3 моль/л, СН2О = 2 моль/л.
Решение.
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей есть тоже величина постоянная и называется константой равновесия К данной системы:
Vпр =k1[CO][H2O]; Vобр = k2 [CO2][H2];

В условии задачи даны исходные концентрации, тогда как в выражение Кравн входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [CO2] = x моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
| Вещества | СО | Н2О | СО2 | Н2 |
| Сисход, моль/л | - | - | ||
| Прореагировало и образовалось | х | х | х | х |
| Сравн, моль/л | (3-х) | (2-х) | х | х |
Зная константу равновесия, находим значение х, а затем и равновесные концентрации всех веществ:
 ;
;
х2 = 6 – 2х – 3х + х2; 5х = 6; х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации:
[CO2] = 1,2 моль/л;
[H2] = 1,2 моль/л;
[CO] = 3 – 1,2 = 1,8 моль/л;
[H2О] = 2 – 1,2 = 0,8моль/л.
Пример 4. При некоторой высокой температуре константа равновесия Кс газовой реакции равна 4. Н2(г) + I2(г) ↔ 2HI(г).
Определить выход НI, если для реакции взято 4 моль/л водорода и 3 моль/л йода.
Решение.
Искомый выход, т.е. равновесную концентрацию HI, обозначим через х. Дальнейший ход решения тот же, что и в предыдущей задаче.

| Вещества | Н2 | I2 | HI |
| Сисход, моль/л | |||
| Прореагировало и получилось | 
| 
| x |
| Сравн, моль/л | 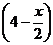
| 
| x |
 отсюда х=3,5 моль/л.
отсюда х=3,5 моль/л.
Пример 5. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
 РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
РСl5(г) → РСl3(г) + Сl2(г); ΔН = + 92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрации, чтобы сместить равновесие в сторону прямой реакции - разложения РСl5?
Решение.
Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: если на систему, находящуюся в состоянии равновесия оказывается внешнее воздействие, то равновесие смещается в сторону реакции, ослабляющей это внешнее воздействие.
а) Так как реакция разложения РСl5 эндотермическая (ΔН> 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в этой системе разложения РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещение равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5 , так и уменьшением концентрации РСl3 или Сl2.
Не нашли, что искали? Воспользуйтесь поиском: