
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ. Концентрацией растворов называется количество растворенного вещества, содержащееся в определенном массовом или объемном количестве раствора или
Концентрацией растворов называется количество растворенного вещества, содержащееся в определенном массовом или объемном количестве раствора или растворителя.
Пример 1. Вычислите: а) массовую долю (ω(А), %); б) молярную (СM, моль/л); в) молярную концентрацию эквивалента (СH, моль .экв/л); г) моляльную (Сm, моль/кг) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр (Т, г/мл) этого раствора?
Решение.
А. Массовая доля растворенного вещества (ω (А)) показывает число грамм вещества, содержащееся в 100 г раствора.
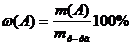 , или
, или  ,
,
или 
где m(A) – масса растворенного вещества, г; mр-ля – масса растворителя, г; mр-ра масса раствора, г; Vр-ра – объем раствора, см3; ρр-ра – плотность раствора, г/см3.
Массу воды 282 см3 можно принять равной 282 г (т.к. плотность воды равна 1г/см3). Масса полученного раствора равна 18 + 282 = 300 г и, следовательно,

Б. Молярная концентрация (СМ), или молярность, показывает число молей (n) растворенного вещества, содержащихся в 1л (дм3) раствора.



В. Нормальная концентрация эквивалента (СН), или нормальность, показывает число моль эквивалентов растворенного вещества А, содержащихся в 1 л раствора.
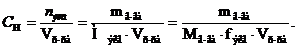

поэтому 
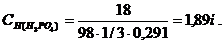
Г. Моляльная концентрация (Сm), или моляльность, показывает число молей растворенного вещества А, содержащихся в 1 кг растворителя:
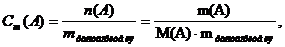
где mрастворителя= mр-ра – m(А),
отсюда 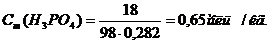
Д. Титром раствора (Т) называется число граммов растворенного вещества в 1 см3 (мл) раствора.
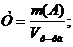

Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5н раствора щелочи. Чему равна нормальность кислоты?
Решение.
Так как вещества взаимодействуют между собой в эквивалентных количествах, то растворы равной молярной концентрации эквивалента (нормальности) реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.:
 , или
, или  .
.
Получаем: 
Пример 3. К 1л 10%-го раствора КОН (ρ = 1,092 г/см3) прибавили 0,5л 5%-го раствора КОН (ρ = 1,045 г/см3). Объем смеси довели до 2л. Вычислите молярную концентрацию полученного раствора.
Решение.
Массовая доля растворенного вещества (КОН) равна

Масса одного литра 10%-ного раствора КОН

В этом растворе содержится вещества КОН
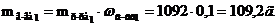
Масса 0,5 л 5%-го раствора КОН

В этом растворе содержится вещества КОН

В общем объеме полученного раствора (2л) масса КОН составляет
mв-ва = 109,2 + 26,125 = 135,325 г.
Отсюда молярная концентрация раствора равна

Пример 4. Какой объем 96%-ной серной кислоты, плотность которой 1,84 г/см3, потребуется для приготовления 3л 0,4н раствора?
Решение.
Молярная масса эквивалента Н2SО4 равна:
Мэкв (Н2SO4) = М(H2SO4)∙fэкв(H2SO4) = 98·1/2 = 49 г/моль∙экв.
Рассчитаем массу вещества Н2SО4, содержащегося в 3л 0,4н раствора:
mв-ва = СН М(Н2SO4)∙fэкв(Н2SО4)·Vр-ра = 0,4∙3·98∙1/2=58,8 г
Найдем массу 96%-го раствора, содержащего 58,8 г Н2SО4:
mр-ра = m в-ва: w = 58,8: 0,96 = 61,25 г.
Из формулы mр-ра = Vр-ра·ρр-ра выразим объем:
Vр-ра = mр-ра: ρр-ра = 61,25: 1,84 = 33,29 мл.
Не нашли, что искали? Воспользуйтесь поиском: