
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Пример 1. Вычислить температуру кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6.
Решение.
По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δt) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением: 
Δt = K·Cm(А), (1)
где К – криоскопическая или эбуллиоскопическая константа; для воды они соответственно равны 1,860 и 0,520; Сm(А) – моляльная концентрация растворенного вещества А, которая рассчитывается по формуле:
Сm(А) =  . (2)
. (2)
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1):
Δtзам. р-ра =  = 0,210.
= 0,210.
Вода кристаллизуется при 0оС, следовательно, температура кристаллизации раствора
tзам. р-ра = 0 – 0,21 = - 0,21оС.
Из формулы (1) повышение температуры кипения 2 %-ного раствора С6Н12О6 равно
Δtкип. р-ра =  = 0,06о.
= 0,06о.
Вода кипит при 100оС, следовательно, температура кипения этого раствора
tкип. р-ра = 100 + 0,06 = 100,06оС.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529о С. Температура кипения сероуглерода 46,3о С. Вычислить эбуллиоскопическую константу сероуглерода.
Решение.
Повышение температуры кипения раствора равно
Δt = 46,529 – 46,3 = 0,229о.
Молярная масса бензойной кислоты равна 122 г/моль.
Из формулы (1) находим эбуллиоскопическую константу

Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,28о С. Вычислить молярную массу глицерина.
Решение.
Температура кристаллизации чистой воды 0оС, следовательно, понижение температуры кристаллизации раствора равно:
Δtзам =0 - (-0,279) = 0,279о.
Подставляем в уравнение (1) данные, находим молярную массу глицерина:

Пример 4. Вычислить массовую долю водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна – 0,465оС.
Решение.
Температура кристаллизации чистой воды 0оС, следовательно,
Δtзам =0 – (-0,465) = 0,465о.
Зная, что молярная масса мочевины 60 г/моль, находим массу m (г), растворенного вещества, приходящуюся на 1000 г воды, из формулы:
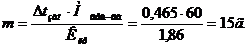
Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г.
Массовую долю мочевины в данном растворе находим из соотношения

Не нашли, что искали? Воспользуйтесь поиском: