
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ИОННО-МОЛЕКУЛЯРНЫЕ (ИОННЫЕ) РЕАКЦИИ ОБМЕНА
Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) HCl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClО и НNO3; г) К2СО3 и Н2SO4; д) СН3СООН и NaOH.
Решение.
Взаимодействие этих веществ возможно либо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, HСlO), осадка (PbS↓), газа (СО2↑). Запишем уравнения взаимодействия указанных веществ в молекулярном виде:
а) НСl + NaOH = NaCl + H2O,
в ионном виде:
H+ + Cl- + Na+ + OH- = Na+ + Cl- + Н2O,
исключив одинаковые ионы Na+ и Cl- из обеих частей равенства, получим краткое инно-молекулярное уравнение:
Н+ + ОН- =Н2О.
б) Pb(NO3)2 + Na2S = PbS↓ + 2NaNO3;
Pb2+ + 2NO 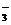 + 2Na+ + S2- = PbS↓+ 2Na+ + 2NO
+ 2Na+ + S2- = PbS↓+ 2Na+ + 2NO 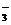 ;
;
Pb2+ + S2- = PbS↓.
в) NaClO + HNO3 = NaNO3 + HClO;
Na+ + ClO- + H+ + NO 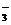 = Na+ + NO
= Na+ + NO 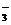 + HClO;
+ HClO;
H+ + ClO- = HClO.
г) K2CO3 + H2SO4 = K2SO4 + CO2↑ + H2O;
2K+ + CO  + 2H+ + SO
+ 2H+ + SO  = 2K+ + SO
= 2K+ + SO  + CO2↑ + H2O;
+ CO2↑ + H2O;
CO  + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
д) В реакции два слабых электролита (СН3СООН и H2O), но так как реакции идут в сторону большего связывания ионов и вода – более слабый электролит (константа диссоциации воды 1,8 · 10-16 (табл. 6)), чем уксусная кислота (константа диссоциации уксусной кислоты 1,8 · 10-5 (табл.6)), равновесие реакции смещено в сторону образования воды:
СН3СООН + NaOH = CH3COONa + H2O;
CH3COOH + Na+ + OH- = CH3COO- + Na+ + H2O;
CH3COOH + OH- = CH3COO- + H2O.
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
a) SO  + 2H+ = SO2 + H2O;
+ 2H+ = SO2 + H2O;
b) Pb2+ CrO  = PbCrO4;
= PbCrO4;
c) HCO 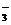 + OH- = CO
+ OH- = CO  + H2O;
+ H2O;
d) ZnOH+ + H+ = Zn2+ + H2O.
Решение.
В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов (табл. 6).
Например:
а) Na2SO3 + 2HCl = 2NaCl + SO2 + H2O;
б) Pb(NO3)2 + К2CrO4 = PbCrO4 + 2KNO3;
в) КНСО3 + КОН = К2СО3 + Н2О;
г) ZnOHCl + HCl = ZnCl2 + H2O.
Не нашли, что искали? Воспользуйтесь поиском: