
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ И СПЛАВОВ
76. Исходя из величины 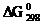 , определите, какие из приведенных ниже металлов будут корродировать во влажном воздухе по уравнению
, определите, какие из приведенных ниже металлов будут корродировать во влажном воздухе по уравнению
Me + H2O + 1/2 O2  Me(OH)2 (Me–Mg, Cu, Au)
Me(OH)2 (Me–Mg, Cu, Au)
77. Какие металлы (Fe, Ag, Ca) будут разрушаться в атмосфере влажного воздуха, насыщенного диоксидом углерода? Ответ дайте на основании вычисления 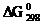 соответствующих процессов.
соответствующих процессов.
78. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии, если эти металлы попадут в кислую среду? Составьте схему гальванического элемента, образующегося при этом. Подсчитайте ЭДС и 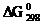 этого элемента при стандартных условий.
этого элемента при стандартных условий.
79. Железо покрыто никелем. Какой из металлов будет корродировать в случае разрушения поверхности покрытия? Коррозия происходит в кислой среде. Составьте схему гальванического элемента, образующегося при этом.
80. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Ответ дайте на основании вычисления ЭДС и 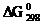 образующегося гальванического элемента.
образующегося гальванического элемента.
81. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит СО2, Н2S, SO2 и др.)? Составьте схему процессов, происходящих на электродах образующегося гальванического элемента.
82. При работе гальванического элемента:
 |
(–) 4Al/4Al3+ | H2O, O2 | (Cr) 12OH–/6H2O, 3O2 (+)
образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с его работы на хромовом катоде восстановилось 0,034л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекающего во внешней цепи гальванического элемента.


 83. Гальванический элемент:
83. Гальванический элемент:
(–) 2Cr/2Cr3+ | H2SO4 | (Pb) 3H2/6H+ (+)
образовавшийся при коррозии хрома, спаянного со свинцом, дает ток силой 6 А. Какая масса хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?


 84. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент:
84. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент:
(–) Sn/Sn2+ | Hcl | (Cu) H2/2H+ (+)
который дает ток силой 7,5 А. Какая масса олова растворится и сколько литров водорода выделится на медном катоде за 25 мин?
85. При работе гальванопары:
 |
(–) 2Fe/2Fe2+ | H2O, O2 | (C) 4OH–/2H2O, O2 (+)
за 1,5 мин образовалось 0,125 г Fe(OH)2. Вычислите объем кислорода, израсходованный на получение Fe(OH)2. Сколько электричества протекло во внешней цепи гальванического элемента за это время?
86. При нарушении поверхностного слоя цинкового покрытия на железе идет процесс коррозии вследствие работы гальванопары:
 |
(–) Zn/Zn2+ | H2SO4 | (Fe) H2/2H+ (+)
За 48 с работы этой гальванопары через внешнюю цепь протекло 550 Кл электричества. Какая масса Zn растворилась при этом и какой объем водорода выделился на железном катоде?
87. При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент:
 |
(–) Fe/0,1 моль/л Fe2+ | 1н HCl | (Cd) H2/2H+ (+)
Определите, как изменится ЭДС гальванического элемента, если концентрация иона Fe2+ возросла до 0,15 моль/л.
88. Никель находится в контакте с золотом во влажном воздухе, насыщенном сероводородом. Коррозия никеля происходит вследствие работы гальванопары:
 |
(–) Ni/Ni2+ |H2O; 0,1 М (=0,07%) H2S | (Au) H2/2H+ (+)
ЭДС этого гальванического элемента равна 0,285 В. Определите, как изменится ЭДС гальванического элемента при его работе, если концентрация ионов Ni2+ возрастает до 0,25 моль/л.
89. При нарушении целостности поверхностного слоя медного покрытия на алюминии будет коррозия вследствие работы гальванопары:
 |
(–) 2  /2Al3+ | H2SO4 | (Cu) 3H2/6H+ (+)
/2Al3+ | H2SO4 | (Cu) 3H2/6H+ (+)
За 45 с работы этой гальванопары на катоде выделилось 0,09 л водорода (измеренного при н.у.). Какая масса алюминия растворилась за это время и какую силу тока дает эта гальванопара?
90. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов и вычислить 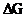 указанных процессов.
указанных процессов.
91. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
92. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
93. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
94. Железные бочки применяют для транспортировки концентрированной серной кислоты, но после освобождения от кислоты бочки часто совершенно разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов.
95. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
96. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
97. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
98. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
99. Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
100. Какое покрытие металла называется анодным и какое катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
Не нашли, что искали? Воспользуйтесь поиском: