
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Промисловий рН-метр рН-101П-АДР
АВТОМАТИЧНИЙ ПРОМИСЛОВИЙ рН-МЕТР
Мета роботи
Вивчення принципу роботи промислового рН-метра, складу вимірювального комплекту й проведення повірки автоматичного рН-метра.
7.2. Загальні відомості про вимірювання рН середовища
Кислотні та лужні властивості розчинів визначаються активністю в них іонів водню. Чиста вода є нейтральною сполукою, якій відповідають як кислотні, так і лужні властивості. Вона дуже слабо дисоціює на іони водню Н+ та іони гідроксильної групи ОН–. Для дистильованої води справедлива наступна рівність
[H+] = [OH–].
За законом діючих мас добуток концентрації іонів водню на концентрацію іонів гідроксила, як для чистої води, так і для водних розчинів, є постійною величиною при заданій температурі, що визначається константою електролітичної дисоціації води:
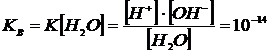 . (7.1)
. (7.1)
Оскільки під час дисоціації чистої води утворюється однакова кількість водневих та гідроксильних груп (H+ = OН–) за температури  , то вважається, що концентрація тих та інших дорівнює
, то вважається, що концентрація тих та інших дорівнює  . На практиці концентрацію водневих іонів числово виражають від’ємним десятковим лагорифмом концентрації іонів водню Н+:
. На практиці концентрацію водневих іонів числово виражають від’ємним десятковим лагорифмом концентрації іонів водню Н+:
 . (7.2)
. (7.2)
рН розчинів (для різних середовищ) наводиться через показник степені:
нейтральне - рН = 7
кисле - рН < 7
лужне - рН > 7.
Потенціометричний метод – найточніший універсальний метод для визначення рН. Грунтується на вимірюванні електродного потенціала, що виникає за умови занурення в розчин спеціальної електродної системи. ЕРС системи залежить від активності іонів водню в розчині, котра в свою чергу визначається не тільки концентрацією, а й температурою, характером розчинника і фізико-хімічними процесами в розчині.
Електродна система завжди складається з двох електродів: вимірювального, потенціал якого функціонально пов’язаний з концентрацією іонів водню в розчині, і порівняльного, або допоміжного, потенціал якого у процесі вимірювання повинен залишатися незмінним весь час.
В якости вимірювальних використовують скляні електроди. Відомі також сурм’яні, водневі, хінгідронні та деякі інші, але на практиці вони використовуються мало.
Як допоміжні поширені каломельні (із сіллю ртуті  ) або хлорсрібні електроди (
) або хлорсрібні електроди ( ). Інші типи практично не використовуються.
). Інші типи практично не використовуються.
Універсальний вимірювальний скляний електрод виготовляється із скляної каліброваної трубки. До одного її кінця наварюється скляна кулька зі спеціального електродного скла з домішками одновалентних металів (Na, Li, K). Під дією електростатичних сил іони металів вириваються зі скла і переходять в розчин, а їх місця заміщуються активнішими катіонами водню (Н+) з розчину. Внутрішня частина корпусу заповнюється 0,1 н розчином HCl. В цей розчин занурений контактний металевий електрод, покритий шаром  , до якого приєднаний вихідний провідник з кабельним наконечником, що відводить потенціал до вторинного приладу.
, до якого приєднаний вихідний провідник з кабельним наконечником, що відводить потенціал до вторинного приладу.
Хлорсрібний допоміжний електрод має незмінюваний потенціал і складається зі срібного стрижня, на поверхні якого нанесений шар малорозчинної солі AgCl. Каломельні електроди, що містять ртуть та її сіль (Hg2Cl2), в харчовій промисловості не використовуються.

Рис.7.1. Схема вимірювання рН розчину:
1– кулька з електродного скла; 2 –вимірювальний скляний електрод;
3 – внутрішній контактний електрод; 4– допоміжний електрод;
5– електролітичний ключ; 6– пориста перегородка
Розглянемо роботу електродної системи, що складається з вимірювального (скляного) 2 і допоміжного (хлорсрібного) 4 електродів, занурених в аналізований розчин (рис.5.1). Між поверхнею скла кульки 1 і розчином проходить обмін іонами. Внаслідок такої взаємодії між поверхнею скла і контрольованим розчином виникає різниця потенціалів Ех (в мВ), зумовлена за законом Нернста активністю іонів водню в розчині:
 , (7.3)
, (7.3)
де Е0 – нормальний потенціал, мВ; R – універсальна газова постійна, Дж/(моль×К); T – температура розчину, К; F – число Фарадея, Кл/моль; ан – активність іонів водню в розчині; n – валентність металу.
Вимірюючи потенціал скляного електрода, зануреного в аналізований розчин, можна визначити значення рН. З цєю метою повинно бути створене електричне коло, що складається із скляного електрода 1, заповненого розчином 0,1н НСl,з допоміжним внутрішнім електродом 3 і зовнішнім допоміжним електродом 4, який для захисту від високих температур вимірюваного середовища найчастіше розташовується поза контрольованим розчином. З’єднання здійснюється через електролітичний ключ – трубку 5, заповнену насиченим розчином KCl, на кінці якої знаходится пориста перегородка, через яку розчин KCl дуже повільно витікає, запобігаючи проникненню в систему порівняльного електрода контрольованого розчину.
ЕРС, що виникає в електродній системі, дорівнює алгебраїчній сумі ЕРС:
 , (7.4)
, (7.4)
де ЕВН – ЕРС між внутрішньою поверхнею скляної кульки та розчином HCl; ЕК, Едоп – ЕРС контактних електродів; Ех –вимірювана ЕРС, яка утворюється на зовнішній поверхні кульки скляного електрода.
Потенціали ЕВН, ЕК, Едоп – постійні за величиною, а Ех – визначається за формулою (7.3) і залежить від рН температури вимірюваного середовища.
Залежність ЕРС електродної системи визначається властивостями вимірювального електрода, коефіцієнтом крутості  характеристики електродної системи й описується формулою:
характеристики електродної системи й описується формулою:
 , (7.5)
, (7.5)
де Еі, рНі – координати ізопотенціальної точки (незалежної від температури), (прикладом, для електродної системи з НСХ ЭС-10802 Еі = -25 мВ, рНі = 4,25); рН – поточне значення рН контрольованого розчину.
Крутість характеристики  залежить від температури контрольованого розчину та задається в паспортних даних на прилад.
залежить від температури контрольованого розчину та задається в паспортних даних на прилад.
Контроль рН розчинів ведеться за схемами безпосереднього вимірювання ЕРС із споживанням струму та компенсаційними. Найчастіше користуються компенсаційним методом, оскільки електродні системи із скляними електродами мають надзвичайно високий внутрішній опір (до 1000 МОм) і вимірювальний опір приладу або перетворювача повинен мати значно більший опір для запобігання похибок вимірювання
 .
.
У разі великих коливань температури вимірюваних розчинів потрібно передбачити пристрій автоматичної компенсації температури.
Промисловий рН-метр рН-101П-АДР
Промисловий рН-метр рН-101П-АДР призначений для вимірювання рН, електрорушійної сили (ЕРС) електрохімічної комірки та температури технологічних водних розчинів промислових підприємств, а також для використання у системах неперервного контролю та автоматичного регулювання технологічних процесів.

Рис. 7.2. Зовнішній вигляд промислового рН-метра рН-101П-АДР
Вимірювальний перетворювач (ВП) складається з двох функціональних блоків – блока вхідних сигналів (БВС), і блока управління та вихідних сигналів (БУВС). Прилад формує вихідний електричний неперервний сигнал (вихідний сигнал) з параметрами згідно ГОСТ 26.011 для інформативного зв’язку з іншими приладами. Вид вихідного сигналу вибирається зі списку вихідних сигналів: 0…20 мА. 4…20 мА, 0…5 мА, 0…50 мВ, 0...100 мВ.
До комплекту постачання приладу входить промисловий датчик типу Д(рН)П-02, який складається з електрохімічної комірки та електроду порівняння, та термоперетворювач опору типу ТСМ 100 для здійснення температурної компенсації.
Прилад має ручну та автоматичну компенсацію температурних змін ЕРС електродів. Діапазон температур, в якому діє ручна та автоматична компенсація темперурних змін ЕРС електродів – від 0 до 120 °С.
Прилад має інтерфейс RS 232 або RS 485 для інформативного зв’язку з іншими приладами за допомогою електричних кодованих сигналів згідно з протоколом обміну ModBus RTU.
Технічні характеристики промислового рН-метра
РН-101П-АДР
Тип промислового датчика Д(рН)П-02
Діапазон вимірювання величини рН, од.рН 0,00…14
Діапазон показів рН 0,00…15
Діапазон вимірювання ЕРС, мВ (-2900,0)…(+1900,0)
Границі допустимої основної
абсолютної похибки, од.рН ± 0,01
Вихідний сигнал
за струмом, мА 0…20, 4…20; 0…5
за напругою, мВ 0…50, 0…100
Живлення, В/Гц ~220/50
Дія приладу грунтується на принципі прямого потенціометричного вимірювання рН у водному розчині.
Значення рН визначаються за формулою (7.6), що описує номінальну статичну характеристику приладу (НСХ):
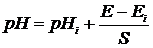 , (7.6)
, (7.6)
де рН – від’ємний десятковий логарифм активності іонів водню;
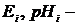 відповідно значення координат ЕРС і рН ізопотенціальної точки первинного вимірювального перетворювача (ВП), мВ;
відповідно значення координат ЕРС і рН ізопотенціальної точки первинного вимірювального перетворювача (ВП), мВ;
Е – значення ЕРС електрохімічної комірки;
S – значення крутизни електродної характеристики первинного ВП, мВ/рН.
7.3. Імітатор І – 01
Імітатор дає можливість встановити напругу, еквівалентну ЕРС електродної системи, в межах від 0 до  1000мВ.
1000мВ.
Напруга на виході імітатора встановлюється за допомогою трьох декадних перемикачів зі ступенями напруги 1, 10 та 100 мВ. Похибка на виході імітатора коливається від  0,5 до
0,5 до  5мВ. Напруга живлення – нормальний елемент класу 0,02 та елемент 373 “Марс” 1,5В.
5мВ. Напруга живлення – нормальний елемент класу 0,02 та елемент 373 “Марс” 1,5В.
7.4. Перелік приладів
1. Лабораторний стенд.
2. Промисловий рН-метр рН-101П-АДР.
3. Імітатор І-01.
Не нашли, что искали? Воспользуйтесь поиском: