
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЗНАЧЕНИЕ БЕЛКОВ ДЛЯ ОРГАНИЗМА ЧЕЛОВЕКА
Белки играют ключевую роль в клетке, присутствуют в виде
главных компонентов в любых формах живой материи. Без белков невозможно представить себе жизнь. Именно в этом смысле сохраняет свое значение опреде- ление Ф.Энгельса: «Жизнь есть способ существования белковых тел». Белки выполняют многочисленные биологические функции. В соответствии с выполняемыми функциями белки классифицируют следующим образом.
1) Белки – ферменты выполняют каталитическую функцию.
2) Структурные белки выполняют опорную функцию, скрепляя биологические структуры и придавая им прочность.
3) Транспортные белки, т.е. участвующие в переносе различных веществ, ионов и др. К ним относят гемоглобин, сывороточный альбумин, липопротеин (транспорт липидов)
4) Пищевые или запасные белки. В эту группу входят яичныйбелок, казеин молока, ферритин («депо» железа в селезенке), глиадин пшеницы, зеин ржи.
5) Сократительные и двигательные белки наделяют клетку или орган
способностью сокращаться, изменять форму или передвигаться (миозин, липиды)
6) Защитные помогают организму преодолевать патологические состояния или бороться с возбудителями заболеваний. Это иммуноглобулины, лизоцим, антитела, лейкоциты.
7) Регуляторные белки участвуют в системе регуляции клеточной или физиологической активности (гормон инсулин).
Значение белков определяется не только многообразием их функций, но и их незаменимостью другими пищевыми веществами. В организме человека под влиянием ферментов протеиназ и пептидаз белки пищи расщепляются до свободных аминокислот.
протеиназа пептидаза

 белок пептиды аминокислоты
белок пептиды аминокислоты
Аминокислоты всасываются в кровь, разносятся по всем органам и расходуются на обновление белков организма.
Нарушение деятельности пищеварительного тракта приводит к попаданию в кровь пептидов. Для человека они чужеродны, в результате может возникнуть пищевая аллергия.
Пищевая ценность белка обуславливается
1) аминокислотным составом;
2) усвояемостью
Некоторые аминокислоты легко образуются в организме из других кислот, но есть так называемые незаменимые амино-кислоты, которые должны поступать с пищей (человеческий организм не способен их синтезировать).
Аминокислотный состав белков прежде всего характеризуется содержанием незаменимых аминокислот. Биологическая ценность белка характеризуется показателем аминокислотный скор, который показывает отношение содержания какой-либо незаменимой аминокислотык ее содержанию в «идеальном» белке.
Наиболее близки к идеальному белку животные белки. Большинство растительных белков имеет недостаточное содержание одной или даже двух-трех незаменимых аминокислот.
Учитывая,что растительные белки менее полноценны, необходимо потреблять больше продуктов животного происхождения. В рационе человека животные белки должны составлять 55% от общего белка.
Животные белки лучше усваиваются организмом человека, чем растительные. Например: белки яиц и молока на 96%, белки хлеба на 85%, картофеля и бобовых на 70%. Это объясняется содержанием в растительных продуктах клетчатки, которая снижает усвояемость компонентов пищи.
Недостаток белка серьезно сказывается на состоянии организма. У детей замедляется рост, задерживается умственное развитие, нарушается образование костей, увеличивается предрасположенность к анемии, рахиту.
У взрослых людей при нехватке белка нарушается обмен веществ, снижается сопротивляемость инфекциям.
Однако избыток белка в питании так же отрицательно влияет на организм: нарушается деятельность печени и почек, возможно ожирение и возникает перевозбуждение нервной системы.
Каждая аминокислота в организме выполняет определенную функцию. Например:
- глицин и глютаминовая кислоты являются регуляторами нервной системы и мозга, они выступают в роли посредников при передаче нервных импульсов
- цистеин-радиопротектор, снижает повреждающее действие радиации
- метионин- обладает липотропнным и антисклеротическим действием и необходим для нормального функционирования печени, почек, сердечно-сосудистой системы.
3.2.3Основные технологические свойства белков
Наиболее важными технологическими свойствами белков являются гидратация, денатурация и пенообразование.
Гидратация.
Белки обладают способностью связывать воду, т.е. проявляют гидрофильные свойства. Гидрофильность белков обусловлена наличием на поверхности
мицелл, заряженных частиц: NH2+, COO¯,PO¯4, OH¯. В изоэлектрической точке (и.э.т.) заряд на поверхности мицеллы белка равен нулю, и поэтому белок теряет способность удерживать воду. При получении сыра и творога молоко подкисляют до и. э. т. казеина 4,6-4,7, образуется сгусток, который легко отдаёт воду с растворёнными веществами (сыворотку).
Гидрофильность белков зависит от структуры белка (сывороточные белки более гидрофильны чем казеины), от рН среды, от присутствия солей.
Связывая воду, белки набухают, увеличивается их масса и объем. Набухание - это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом. Этот процесс сопровождается увеличением массы и объёма полимера. Причиной набухания является диффузия молекул растворителя в высокомолекулярное вещество. Между молекулами полимера обычно имеются небольшие пространства, размер которых соизмерим с размерами молекул растворителя. Благодаря этому молекулы низкомолекулярной жидкости достаточно быстро проникают между макро молекулами, раздвигая сетку белка
 |  | ||||
 | |||||










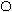
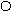
 Н2О
Н2О

















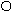
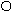







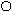
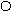















 Н2О
Н2О
 |  | ||||||||||||||||
 |  |  |  |  | |||||||||||||
 |  | ||||||||||||||||




 -Н2О +Н2О
-Н2О +Н2О
Рис.3.2. Схема набухания белка и синерезиса
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не обладают текучестью, они упруги, обладают пластичностью, способны сохранять форму.
Гидрофильные свойства белков имеют большое значение в пищевой промышленности. От гидрофильных свойств белков зависят структурно-механические свойства молочных сгустков, их способность отдавать влагу, а так же консистенция готовых продуктов. В плавленых сырах белок имеет более высокие гидрофильные свойства, чем в натуральных сырах, за счёт введения солей-плавителей, поэтому консистенция у них более мягкая, пластичная, даже мажущаяся.
Денатурация – сложный процесс, при котором происходит изменение нативной пространственной структуры белка, т.е. изменение четвертичной, третичной и вторичной структуры макромолекулы белка. Первичная структура и химический состав белка при этом не меняются.
 | |||||||||||||
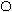 | 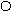 | ||||||||||||
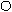 |  | ||||||||||||
 | |||||||||||||
 | |||||||||||||
Мицелла белка отдельные субмицеллы
 | |||||
 | |||||
 | |||||
Нативная форма хаотический клубок
Рис 3.2. Схема денатурации белка
Денатурация происходит под воздействием внешних факторов: температура, механическое воздействие, химические реагенты.
При денатурации изменяются физические и химические свойства белка (его влагоудерживающая способность, растворимость), меняется форма белковой молекулы, происходит их агрегирование, изменяется биологическая ценность и прежде всего усвояемость белка.
Большое практическое значение в пищевой промышленности имеет тепло-
вая денатурация. Белки зерна и других растений после тепловой обработки становятся более доступными для пищеварительных ферментов. В некоторых случаях, наоборот белки вступают в реакцию с другими компонентами пищи и образуют комплексы, которые трудно перевариваются.
Умеренная тепловая обработка не вызывает изменения аминокислот и несколько улучшает переваривание за счёт денатурации и инактивации ингибиторов ферментов. Это относится к сывороточным белкам и растительным белкам (белки злаковых, гороха, фасоли). Казеин сырого молока характеризуется рыхлой структурой и поэтому обладает высокой степенью перивариваемости без предварительной денатурации. Длительная высокотемпературная обработка может привести к снижению его биологической ценности.
Пенообразование - способность белков образовывать высококонцентрированные системы жидкость-газ. Такие системы называются пенами.
Образование пенообразующей структуры белками возможно в связи с их способностью понижать поверхностное натяжение на грани раздела жидкость-газ.
Хорошие пенообразующие свойства имеют белки яиц, казеинаты и некоторые растительные белки.
Пены образуются при интенсивном механическом воздействии: встряхивании, сбивании, перекачивании, перемешивании и кипении. При выработке масла методом сбивания перед появлением масляных зёрен образуется крупноячеистая пена.
В некоторых случаях образование пены является нежелательным процессом. Например: при перекачивании или наполнении ёмкостей пена легко переливается через край и с ней теряются сухие вещества. При выпаривании обезжиренного молока и сыворотки в вакуум-выпарной установке происходит сильное пенообразование, это затрудняет ведение процесса. В данном случае используют пеногасители.
Гидролиз белков. Важное значение в пищевой технологии имеет расщепление белков под действием ферментов на пептиды и аминокислоты
 O H H протеаза О
O H H протеаза О
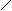





 R – CH – C – N - CR2 + H2O R1CHC + R2CH - COOH
R – CH – C – N - CR2 + H2O R1CHC + R2CH - COOH
 |  |  |  |
NH2 COOH NH2 OH NH2
Протеиназа пентидаза


 Белок пептид аминокислота кето
Белок пептид аминокислота кето
кислоты, альдегиды, кетоны, NH3, CO2, и т.д.
При созревании сыров происходит протеолиз белков. В результате образуются вещества которые создают определённый вкусовой букет сыра.
Реакция меланоидинообразования. При длительной тепловой обработке пищевых продуктов (при топлении молока, выпечке хлеба) они приобретают коричневый или бурый цвет за счёт образования меланоидинов – продуктов реакции Майара.
белок (аминогруппа) + углеводы (альдегидная группа) t ° С
 меланоидины
меланоидины
Ферменты (от лат. fermentum – закваска) – биологическиекатализаторы белковой природы ускоряющие химические реакции. Белки в составе ферментов могут быть простыми или сложными. Небелковая часть в составе фермента называется коферментом.
Коферментами могут быть металлы, витамины и др. соединения.
Ферменты называют по тому веществу, на которое они действуют, (субстрат) и прибавляют окончание “ аза”. Протеаза, пептидаза, липаза, лактоза и т.д. Кроме этих рабочих названий имеются более сложные систематические названия, отражающие механизм действия ферментов.
Действие фермента строго специфично, т.е. каждый фермент катализирует только одну химическую реакцию. На первой стадии ферментативной реакции фермент соединяется с субстратом. При этом образуется фермент-субстратный комплекс, который затем преобразуется с разрывом химических связей субстрата. Продукты реакции затем отщепляются от фермента.

 А1А2 + Ф А1А2Ф А1 + Ф + А2
А1А2 + Ф А1А2Ф А1 + Ф + А2
Ферменты действуют при определённой температуре и рН cреды; их активность зависит от наличия химических веществ-активаторов и ингибиторов. Оптимальная температура действия ферментов 30 – 50°С. При дальнейшем повышении температуры активность ферментов снижается, потому что денатурирует белок, образующий фермент.
Важным фактором, влияющим на активность ферментов является рН среды. Ферменты различаются по оптимальным для их действия рН. Так, оптимум действия пепсина находится при рН 1,5 – 2, амилазы слюны – 7,2 - 7,3.
Известно около 3 тысяч различных ферментов. По современной классификации их делят на 6 классов:
1)Оксиредуктазы катализируют окисление и восстановление веществ.
2)Гидролазы катализируют гидролитическое ращепление сложных соединений: протеазы, липазы, лактазы.
3) Изомеразы – ферменты изомеризации катализируют структурные изменения в пределах одной молекулы.
4) Трансферазы катализируют перенос различных групп от одной молекулы к другой.
5) Лиазы – ферменты отщепления групп.
6) Синтетазы катализируют образование связей С – N, C – O, C– S
Наибольшее значение в технологии имеют ферменты гидролазы и оксиредуктазы.
Контрольные вопросы
1) Как можно классифицировать белки?
2) Химическое строение белков.
3) Как образуется первичная, вторичная, третичная и четверичная структура белков?
4) Какова роль белка для организма человека?
5) Назовите функции отдельных аминокислот в организме человека.
6) Расскажите об основных технологических свойствах белков (гидратация, денатурация, пенообразование).
7) Какое значение имеют процессы гидролиза белков и меланоидинообразования в пищевой технологии?
8) Что такое ферменты, приведите их классификацию?
2.3 Липиды
2.3.1 Классификация и строение липидов
Липиды (от греческого lipos – жир) – это общее название жиров и жироподобных веществ, обладающих одинаковыми физико-химическими свойствами. Липиды не растворяются в воде, но хорошо растворяются в органических растворителях (эфирах, хлороформе, бензине).
По химическому составу липиды делятся на простые и сложные. К простым относятся нейтральные жиры или ацилглицерины и воска; к сложнымфосфолипиды, гликолипиды, стерины и жирорастворимые пигменты и витамины.
Ацилглицерины (глицериды)- это сложные эфиры трехатомного спирта глицерина и жирных кислот. В природных жирах могут так же присутствовать продукты гидролиза или неполного синтеза триглицерида (ТГД). Все они построены по следующему типу:

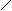


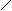
 О О О
О О О
СН2 – О – С – R1 СН2 – О – С – R1 СН2 – О – С – R1






 О О
О О


 СН - О – С – R2 СН – О – С – R2 СН – О – Н
СН - О – С – R2 СН – О – С – R2 СН – О – Н

 О
О
СН2 - О - С– R3, СН2 – О – Н СН2 – О – Н
ТРИГЛИЦЕРИД ДИГЛИЦЕРИД МОНОГЛИЦЕРИД
В нейтральных жирах обнаружено несколько десятков различных жирных кислот, которые делят на насыщенные и ненасыщенные. Чаще других встречаются из жирных насыщенных кислот:
Лауриновая (С12): СН3-(СН2)10 - СООН
Миристиновая (С14): СН3-(СН2)12 - СООН
Пальмитиновая (С16): СН3-(СН2)14-СООН
Стеариновая (С18): СН3-(СН2)16 - СООН
Из ненасыщенных жирных кислот:
Олеиновая С(18:1): СН3-(СН2)7-СН=СН-(СН2)7-СООН
Линолевая С(18:2): СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН
Линоленовая С(18:3): СН3-(СН2-СН=СН)3-(СН2)7 - СООН
Две последние жирные кислоты являются незаменимыми, так как не синтезируются организмом человека.
Восками называют сложные эфиры высокомолекулярных одноосновных карбоновых кислот (С18 – С30) и одноосновных высокомолекулярных спиртов:

 О
О
 R – СН2 – О – С
R – СН2 – О – С
R1
Они образуют защитное покрытие листьев, плодов растений, предохраняя их от смачивания водой, высыхания и действия микроорганизмов. А так же образуют защитную смазку перьев и кожи. Наиболее известны пчелиный воск и спермацет кашалотов.
Фосфолипиды. Они отличаются от триглицеридов тем, что в их состав кроме глицерина и жирных кислот входят фосфорная кислота и азотистое основание:
СН2 – О – СОR1

 СН – О – СОR2
СН – О – СОR2
 ОН
ОН
СН2 – О – Р – О – А

 О
О
где А - азотистое основание, чаще всего представлено холином
(в лецитине) или этаноламином (в кефалине).
Фосфолипиды являются основными структурными компонентами биомембран. Особенность молекул фосфолипидов состоит в том, что они построены из двух частей: гидрофильной (несущей электрические заряды головки) и гидрофобной (длинных углеводородных цепей - хвостов). Рис 10.

|
Рис. 10 Схематическое изображение молекулы фосфолипида

Рис. 11 Схема эмульгирования жира фосфолипидами.
1 – неполярные хвосты;
2 – полярная головка.
Наличие у молекул фосфолипидов двух частей обусловливает их способность эмульгировать жиры (рис 11). Фосфолипиды широко применяются в пищевой промышленности в качестве поверхностно активных веществ.
Стерины представляют собой высокомолекулярные циклически спирты. Стерины построены следующим образом:
Н3С R

Один из важнейших представителей стеринов - холестерин. В организме холестерин находится как свободном состоянии, так и в виде сложных эфиров с жирными кислотами (стеридов).
Среди жирорастворимых природных пигментов наиболее распространены каротиноиды и хлорофиллы.
Каротиноиды - растительные красно-желтые пигменты, обеспечивающие окраску ряда жиров, овощей, фруктов, яичного желтка.
Хлорофиллы - придают зеленную окраску растениям.
Не нашли, что искали? Воспользуйтесь поиском: