
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Дәріс. Минералдар және олардың агрегаттарының морфологиясы. Минералдарды жүйелеуінің негізі
Минералдардың морфологиясы олардың сыртқы пішінін сипаттайды.
Минералдардың морфологиялық ерекшеліктері: габитусы, келбеті және жақтарының сызықталуы.
Габитус – минералдардың кристалдық пішіндері, өз симметриясына сай қарапайым пішіндері. Мысалы, кубтық сингониясынын минералдарының габитустары: гексаэдр, октаэдр және т.б.
Минералдар қысым көрген жағдайда дұрыс кристаллографиялық пішін бермейді, бұл жағдайда оның келбетің сиппатайды, олардың 3 түрі бар: изометриялық (кубтық сингониядағы минералдарға тән); ұзартылған – қысқа призмалық, ұзын призмалық, қадалы, ине тәріздес, талшықты (ортанғы категориядағы минералдарға); жалпақ – тақталы, пластинкалы, жапырақша, қабыршақша (төменгі категориядағы минералдарға). Үш кристаллографиялық бағытта дамыған кристалдар изометриялық келбетті болады. Бір бағытта өскен кристалдар жалпақ келбетті, ал үш бағытта бірдей емес дамыған кристалдар ұзартылған болады.
Жақтарының сызықталуы – ол кристалдардың өскен жағдайында жағына сызықтар пайда болу қасиеті. Мысалы, кварцта өсуіне перпендикуляр сызықтар пайда болады; турмалинде – параллель сызықтар.
Дарақтар – минералдардың жеке кристалы немесе түйірі. Минералдардың кристалдар жиынтығы, топтасқан түйіршектері агрегаттар деп аталады. Егер бір минералдаң түзілсе мономинералды агрегат, бірнеше минералдан – полиминералды агрегат деп атаймыз. Минералды агрегаттар деп, біз көбінесе таужыныстар мен кендерді атаймыз. Кристалтүйірлік минералдық агрегаттарда, түйірлердің шекарасы көрінеді, ал жасырын және аморфты агрегаттарда – көрінбейді. Бір өлшемді түйірлермен құралған түйірлі агрегаттар, біркелкі түйірлік, ал агрегаттар әртүрлі өлшемді түйірлерден тұрса, ол әркелкі түйірлік деп аталады.
Борпылдақ (болбыр) агрегаттар, топырақтың кесектеріндей бос болады, ал тығыз агрегаттарда түйірлер бір-біріне жапсарласып тұрады.
Минералдар агрегаттарының морфологиясы сан алуан, кен тарағандары төменде қарастырылған.
Плагиоклаздарға полисинтетикалық егіздіктер, ал касситеритке, гипске – қарапайым егіздіктер тән (…13 суретке сәйкес). Плагиоклаздың полисинтетикалық егіздіктері мөлдір тілімтастамикроскоппен зерттегенде көрінеді, сол кезде микроскоптың үстелшесін 1800 айналдырғанда, дарақтардың бір қатары сөнеді, ал бір қатары, ақ боп тұрады. Минералдың қ арапайым егіздіктері екі дарақтармен құрастырылған, ал үш дарақтардың бірге өсуін, үштік деп атайды. Екі индивидтердің шектерін егіздік жазықтығы деп атайды. Кейде пішіні немесе құрамы жақын әртүрлі минералдар бойынша заңды бірге өсуі байқалады.
Сферолиттерде инеше немесе ұзын призмалық кристалдар тарамдары радиалды-сәулелі сәулесін шашқан күн тәріздес боп келеді (…13 суретке сәйкес).
Өсімдік тәрізденіп өсетің кристалдарды дендриттер деп атайды (дендрон – грекше ағаш), олар өсімдіктердің басылымдарының іздеріне (әдетте папоротниктердің) ұқсас келеді. Олар ерітінділердің таужыныстардағы өте жұқа жарықшаларынға кіргеннен пайда болған. Өте кен тарағаны марганецтің тотықтарының және мыстың дендриттері болады. Тағыда дендриттер сомтума алтын, күміс және темір сияқты металдар қоспаларында жиі кездеседі (…13 суретке сәйкес).
1  2
2  3
3  4
4  5
5 
6  7
7  8
8  9
9  10
10 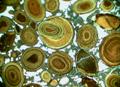
1) Друзадағы кварцтың егіздігі; 2) ставролиттің егіздігі; 3) эгириннің чароиттағы сферолиттері; 4) марганец тотықтарының дендриттері; 5) сомтума алтынның дендриті; 6) аметистің друзасы; 7) гипстің «дала раушангүлі»; 8) аметистпен кварцтың жеодасы; 9) фосфориттің тасберіші; 10) лептохлоритті таужынысының мөлдіртастағы оолиттік құрылымы.
13 сурет – Минералдардың морфологиясы
Друза (щетке) – ол бір тұғырда заңсыз қырланып өскен кристалдар тобы. Друзалар ерітінділермен қабаттасып желілерде немесе құыстардың іргесінде өседі. Табиғатта кварцтың, кальциттің, аметистің, флюориттің, пириттің және т.б. друзалары кездеседі, кейбіреулері гүл тәріздес болады (…13 суретке сәйкес).
Тасшемендер (секрециялар) – құыстарды толтырған, келбеттері түзу емес, домалақ денелер, коллоидты немесе кристалдық заттармен құрастырылған, олар концентрлік-белдемді орналасқан. Тасшемендер таужынастардың қуыстарында және үнгіршелерінде, іргесінен ортаға қарай, мономинералды заттармен толтырады. Кейде, кейбір белдемдер жиі, бір-бірінен түсімен және құрамымен ажыратылып тұрады. Ұсақ тасшемендерді (көлденені 10 мм дейін) миндалиналар дейді, олар кейбір эффузивтерге тән. Ірі тасшемендер (көлденеңі 10 мм ден зорлар) жеода деп аталады, оларда, орталарында қуыстар, қабырғаларында кристалдар және сауыстаңған заттар болады. Олар кейде концетрлік-белдемді болады (…13 суретке сәйкес).
Тасберіштер (конкрециялар) – шар тәріздес немесе дұрыс емес пішінді денелер және түзілімдер, ішкі құрылымы кейде радиалды-сәулелі, сферолиттік (пирит, марказит, фосфориттер) не түйіршекті (құмтастар). Ташемендерге қарағанда, тасберіштер ортасынан іргесіне қарай өседі. Тасберіш, негізінде шөгінді таужыныстарына тән, көбінесе саздар арасында кездеседі. Олардың көлденең өлшемі миллиметрлерден ондаған сантиметрлерге және метрлерге дейін болады (…13 суретке сәйкес).
Оолиттер («oon» – «жұмыртқа», «литос» – «тас» деген грек сөздерінен шыққан) – сфералық түзілімдер, өлшемі 0,1 – 2 мм дейін, концентрлік немесе қабықша құрылымды. Оолиттер сулы ортада пайда болады, белгілі бір ынғайлы жағдайда, еріген заттар құмдардың түйірлерінің, тозанның және ауаның үлбіреуінің төңірегінде, топтаса бастайды. Егер түзілімдер 2,0 мм жоғары болса, оларды пизолиттер — («písos» – «бұршақ», «литос» – «тас» деген грек сөздерінен шыққан)деп атайды. Оолиттер арагонитке, бокситтерге, фосфориттерге және т.б. тән (…13 суретке сәйкес).
Минералдық агрегаттардың сауыстанған пішіндері – коллоидтар-гельдер арқылы пайда болады. Ашық жазықтарда, аққан судан бөлінген сауыстаңған минералдық түзілімдер тамшылы, сорғаламалы, пленкалы ерітінділердің түзілімдерінен құралады. Морфологиялық түрлері көп болады.
Сталактиттік, сталагмиттік сауыстанған минералдық түзілімдер құыстарда немесе үңгілерде жиі кездеседі.
Сталактиттер (гр. «stalaktos» – «тамшылы аққаны») – сауыстанған минералдық түзілімдер (жиі әкті), төбеден және үңгірдің жоғарғы бөлігінен салбыраған сүмелек мұздар тәріздес, құбырлар, тарақтар, шашақтар тәріздес болады. Су булануында кальций көмір қышқылының шөгу нәтижесінде пайда болады.
Сталагмиттер (гр. «stalagma» – «тамшы») – сауыстанған минералдық түзілімдер (жиі әкті), үңгірдің түбінде жоғарыдан түсетін минералданған сулардың булануынан пайда болады және ол томеннен жоғары өседі. Олар конус, бағана түрлес болады. Конус түрлес әкті-тамшылы түзілімдері, үңгірдің табанынан сталактиттерге қарсы өседі.
Бүйрек тәріздес агрегаттар карстық үнгірлерде, кеннің тотығу белдемдерінде жиі кездеседі, малахит, гематиттерге (қызыл шыныша бас), халцедонға және басқа минералдарға тән. Осы агрегаттар ішінде белдемді боп келетіндер бар, оны заттардың ерітінділерінен, соның ішінде коллоидтардан қабат-қабат түзілгенімен түсіндіріледі.
Параллель бағаналы және талшықты агрегаттар – таужыныстардың жарықшаларында (көбінесе) не құыстарында (cирек) пайда болады. Мысалы, амфиболдық асбестер, гипс, турмалин және т.б. Минералдардың гельдерінен кристалданған кезде, гель жарықшақтардың керегелеріне жабысып, олар біртіндеп ашылған кезде созылып жеке параллель орналасқан талшықтардың агрегаттарына айналады.
Жер тәріздес агрегаттар депұнтақ таріздес жұмсақ түзілімдерді атайды. Олар түсіне байланысты бөлінеді: күйе тәріздес (қара түсті марганец сулу тотығы), жоса тәріздес (сары – лимонит).
Минералдардың ұшпақтары және жағылымдары минералдардың немесе таужыныстарының үстінгі жақтарында өте жұқақабыршақтар түрінде пайда болады. Мысалы, мыстың жасылының, темір гидроксидтердің жағылымдары.
Түсті бояулардың дағы – мезгілді жеңіл ерігіш тұздардың таужыныстарының, топырақтардың үстінгі жазықтарында, түзілімдердің жарықшаларында дақ қалтыруы.
Псевдоморфозалар («псевдо» – «бөтен», «морфос» – «пішін») өзіне тән емес пішінді иеленіп алған минералдар. Мысалы, лимониттің пиритті толық аыстырғаны, тасталған ағаш діңі – кремний Жер астында көміліп қалған ағаш діңнің құыстарын толтырған.
Егер жаңадан пайда болған минерал өзі ығыстырып отырған минералмен химиялық құрамы бірдей болса онда псевдаморфозалар параморфозалар деп аталады
Минералдардың агрегаттарының бітімі деп минералдардың орналасу ерекшеліктерін айтады. Мысалы, құмтастардың бітімі көбінесе қабатты боп келеді, эффузивтердің – ағынды.
Құрылымы деп минералдардың агрегаттарының ішкі құрылысының ерекшеліктерін айтады. Ол оның кристалдығына, оны құрайтын минералдардың пішініне, олардың өз ара қатынасына және минерал түйірінің өлшеміне байланысты. Іріліктеріне қарай топтасқандар: а – зор түйірлік (өлшемі 20 мм >); б – ірі түйірлік (өлшемі 5 ден 20 мм); в – орта түйірлік (өлшемі 1 ден 5 мм); г – майда түйірлік (өлшемі 0,1-5 мм); д) микротүйірлік (<0,1 мм). Мысалы, құмтастардың құрылымы – псаммиттік, орта түйірлік.
Минералдарды жүйелеу. Қазіргі заманда пайдаланатын минералдардың, яғни табиғи қосылыстардың, жүйелеу негізін қалаған Швецияның химия және минералогия ғалымы И.Я. Берцелиус (1814). Кейін Дж. Дэна (1850) осы химиялық негізін басшылыққа алып "Минералогия жүйесі" атты көп томдық анықтама еңбегінде барлық минералдарды келесі топтарға (кластарға) бөлді: 1) табиғи таза (сомтума) элементтер, 2) күкіртті және мышьякті қосылыстар, 3) галогенді қосылыстар,4) оттек қосылыстары, 5) органикалық заттар.
Қазіргі заманда көп тараған көзқарасқа кристаллохимиялық жүйелеу әдісі жатады. Өткен ғасырдың отызыншы жылдарында В. Брегг және В. Гольдшмидт силикаттарды жүйелеу үшін кристаллохимиялық әдіс ұсынды. Кейін осы бағытта зерттеу жүргізіп, бүл білімнің дамуына қомақты үлес қосқан А.Г. Бетехтин, Е.К. Лазаренко, В.С. Соболев, А.С. Поваренных, Г.П. Барсанов, А.А. Годовиков.
Бұл ғалымдардың пікірі бойынша минералдарды топтастыру кезінде олардың басқа да қасиеттерін есепке алу қажет, яғни кристалдардың ішкі құрылым ерекшелігін, минералдарды құрайтын бөлшектер арасындағы химиялық байланыс түрлерін, бөлшектердің тығыз қалану тәртібін, олардың координациялық сипаттарын және т.б. Осы принцип бойынша, барлық бейорганикалық минералдарды біз келесі кластарға бөліп зерттейміз: 1) сомтума элементтер; 2) сульфидтер; 3) тотықтар және сулы тотықтар; 4) галогенидтер; 5) карбонаттар; 6) сульфаттар; 7) ұсақ кластар: а) фосфаттар; б) арсенаттар; в) вольфраматтар және молибдаттар және т.б.; 8) силикаттар класының топтары:а) аралдық силикаттар, б) тізбекті және таспалы силикаттар және алюмосиликаттар, в) қабатты силикаттар және алюмосиликаттар, г) қаңқалы алюмосиликаттар.
Класс дегеніміз басты анионына қарай немесе радикалына байланысты өзгешеленген химиялық қосылыстар, яғни минералдар. Мысалы, сульфидтер, оксидтер, силикаттар, карбанаттар, сульфаттар және т.б. кластар.
Кластар ішінде бір химиялық байланыс түрі басым болады, топтарға құрамы және қүрылымы жақын минералдар бөлінеді. Сонда жүйелеу түрі мұнандай болады: минерал –– топ –– класс.
Химиялық элементтердің көпшілігі табиғи жағдайда қосылыстар түрінде кездеседі. Бірақ кейбір элементтер қосынды түрінде және өз алдына жеке элемент түрінде де, ал басқа элементтер тек қосынды түрінде немесе тек жеке элемент түрінде ғана кездеседі. Элементтердің мұндай болып кездесуі, олардың химиялық қасиеттеріне және айналасындағы геологиялық жағдайларға байланысты.
Минералдарды сипаттағанда келесі деректерді қолданамыз: минералдың химиялық құрамы; олардың ішіндегі элементтер қоспалары; структуралық және кристаллографиялық сипаттары (құрылымының өзгешелігі, сингониясы, симметрия түрі және символы, кеңістік торы, элементарлы үяларының параметрлері, кристалдардың пішіні және қарапайым пішіндер жақтарының символдары т.б.); агрегаттары; физикалық қасиеттері; диагностикалау белгілері; үқсас минералдардан ерекшеленуі; типоморфтық ерекшеліктері; минералдарды пайдалану салалары; практикалық маңызы.
Бақылау сұрақтар:
1. Дарақтар және минералдық агрегаттарының морфологиясы қандай болады?
2. Минералдар агрегаттарының бітімі, құрылымы немен сипатталады?
3. Минералдардың жүйелеуі, олар қандай кластарға бөлінеді?
Дәріс Кристаллохимия негіздері. Химиялық байланыстардың түрлері, координациялық сан. Шарлардың тығыз қалануы. Сомтума элементтер класының жалпы сипаттамасы
Минералогия үшін минералдардың химиялық құрамы, симметриясы және қасиеттері арасындағы байланыс заңдылықты жете зерттейтін ғылым саласы кристаллохимияның маңызы аса зор. Бұл білімнің тарихы өте ертеден басталады. Алғаш XVIII ғасырда М.В. Ломоносов және Р.Ж. Аюи кристалдардың іш құрылымын, олардың сырт пішінімен және қасиеттерімен байланыстырды. Р.Ж. Аюи де кристалдық көп жақтылардың осындай тығыз қаланған шарлардан құралған бөлшектерден тұратынын анықтады. 1912 жылдан бері, Лауэ, Брегг, Вульф және т.б. рентгеноструктуралық зерттеу әдісі арқылы, барлық минералдардың кристалдық құрылымын толықтай зерттеді.
Атом ядросының оң заряды – протон, оның сыртындағы электрон қабатының теріс зарядына тең болады. Оң және теріс зарядталған иондар – анион және катион деп аталады. Болжау бойынша, атомдар мен иондардың сыртқы пішіндері сфера (шар) тәріздес. Олардың радиустары атомдық немесе иондық радиустар деп аталады. Олар ангстреммен өлшенеді, 1 А0 – 10-10 м тең. Иондық радиус шамасы, оның валентілігімен байланысты, валентілік артқанда радиус шамасы кішірейеді. Аниондар катиондардан ірілеу болады. Мысалы, атомдар радиусы: С – 0,77 А0; N – 0,71 А0; аниондардың радиустары – Cl-1 – 1,61 А0; О-2 – 1,32 А0; катиондардың – Mg+2 – 0,78 А0; Fe+3 – 0,67 А0.
Атомдардың арасындағы химиялық байланыс олардың агрегаттық қалыпына байланысты емес, ол электрондардың валентілігімен байланысты сипатталады. Химиялық байланыстадың төрт негізді түрін бөледі: металдық, коваленттік, иондық, ван-дер-ваальстік.
Металдық байланыс элементердің периодтық кестесінің бірінші тобына және интерметаллидтерге тән, олар бос электрондардың және оң зарядталған ядролардың бір-бірімен әрекеттенуімен пайда болады. Металдардың бар атомдары өздерінің валенттік электрондарын жалпы қолдануға береді, оның нәтижесінде «электрондық газ» пайда болады. Бұл байланыс бағдарлы әлде сфералық симметриялық емес, осының әсерінен металдардың негізді қасиеттері түсіндіріледі: жоғарғы тапталғыштығы, жылы өткізгіштігі, электр өткізгіштігі, төмен қаттылығы, балқу және қайнау нүктелерінің төменділігі. Металдық байланыста атомдар өте тығыз орналасқан. Оларға жоғарғы координациялық сандар тән (КС › 8).
Коваленттік (гомеополярлық) байланыс екі көршілес атомдардың сыртқы валенттік орбиталарында электрондардың ортақ болуынан, және оладың екеуі де тұрақты асыл-газды элементтің конфигурациясына ие болуымен пайда болады. Коваленттік байланыс қатау, бағдарлы, қанық және өте берік. Осындай байланыс түрлері бар кристалдар нашар ерігіш, қаттылықтары жоғары, балқу және қайнау нүктелері жоғары, мортты, шала электр өткізгіш болады. Атомдардың координациялық саңдары төмен, тығыз қалану жоқ. Мысалы боп алмас келтіріледі.
Иондық (гетерополярлық) байланыс оң зарядталған катиондар мен теріс зарядталған аниондардың электростатикалық (кулондық) қарымқатынастарынан пайда болады. Байланыс бағдарсыз және қанықсыз. Иондардын электростатикалық тарту күші және осындай молекулалардың тұрақтылығы, олардың иондарының зарядына және олардың өлшеміне байланысты болады. Заряд неғұрлым үлкен болса, соғұрлым ион майда, және ол өзінің көршілерімен тығыз байланысты болады. Иондық байланысты кристалдар суда ерігіш болады, оларға диэлектірлік қасиет, морттылық, төмен жылу және электр өткізгіштік, орта тығыздық және қаттылық, өте жоғары балқу және қайнау нүкетелері тән. Иондық байланысты құрылымдар жоғары координациялық сандармен және атомдардың тығыз қалануымен сипатталады. Егер әр ион тек қарама-қарсы зарядталған ионмен жапсарласса, минералдың кристалдық құрылымы тұрақты болады, демек катиондардың қатынасу алаңы (өлшемі майдалау) аниондардың алаңдарымен жапсарласады (өлшемі үлкенірек), ал соңғылары бір-бірімен жапсарласпайды. Иондық байланыс минералдық ортада галогенидтерде, нитраттарда, сульфаттарда, карбонаттарда болады. Иондық байланысы бар минерал галит.
Ван-дер-ваальстік (қалдықты) байланыс бейтарапты молекулалардын арасында, дипольдық кезеңдегі «ядро-электрон» арасындағы тартылыс күштің әсерінен пайда болады. Осы құбылыс дисперстік эффект деп аталады, ол ван-дер-ваальстік байланыстын пайда болуының басты себебі болады. Осы байланыс химиялық байланыстардың ең нашары, ол минералдарда қосымша болғанда, минералдарға жымдастық және төмен қаттылық тән болады (графит).
Шарлардың тығыз қалануы. Бірдей бөлшектерден тұратын, жеке элементтер класындағы минералдардың кристалдық құрылысын құрастырғанда, олардың атомдарының барлығы, бірдей сфералық (шарлардың), радиустары да бірдей, демек кристалдық торда шарлар тығыздалып орналасады (...14 суретке сәйкес).
1  2
2 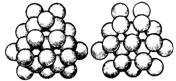 3
3  4
4 
а б
14 сурет – Шарлардың жазықтықта тығыз қалануы (1), екі қабатта орналасуы (2) а – бітеу шұнқырлар; б – ашық шұнқырлар және тығыз қалануы (3) – кубтық тығыз қалану; (4) – гексагондық тығыз қалану.
Бірдей шарлардың қалануының екі әдісі бар кубтық және гексагондық. Шарлардың екі қабатын, бірінің үстіне екіншісін тығыз орнастыратын болсақ, әрбір түйіскен үш шардың аралығындағы шұңқырлар, екі түрлі болады. Олардың бірі, астыңғы қабаттағы шарлардың аралығына келеді, оны бітеу шұңқырлар дейді, екіншісі екі қабаттан бірден өткен шұңқырларды – ашық шұңкырлар деп атайды (...14 суретке сәйкес). Үшінші қабаттағы шарлар, ашық шұңқырлардың үстіне тұра келсе, онда кубтық тығыз қалануы болады. Ал үшінші қабаттағы шарлар бітеу шұңқырлардың үстіне тұра келсе, онда гексагондық тығыз қалануы болады (...14 суретке сәйкес). Кубтық тығыз қалану түрінде құралған металдарға – мыс, күміс, платина, алтын және т.б. жатады. Гексагондық тығыз қаланған элементтерге жататындар: бериллий, магний, мырыш және т.б. Тығыз қалану құрылым, тек сомтума элементтерде ғана емес, сонымен қатар, күрделі қосындыларға тән. Мысалы, ірі сфералы аниондар, өз ара тығыз қаланғанда, олардың араларындағы бос орындарға ұсақ сфералы катиондар орналасады.
Әрбір атомның айналасында, бірдей қашықтықта орналасқан ең жақын атомдардың санын, координациялық сан деп атайды. Кубтық және гексагондық тығыз қалану құрылымында, әрбір атомның айналасында 12 атом болады, демек координациялық саны 12. Кристалдық симметриялық тор заңы бойынша, координациялық сандар 2, 3, 4, 6, 8, 12 болады. Катион радиусының анион радиусына қатынасы 0 болса, үйлестік саны 2 болады; 0,15 – 3; 0,22 – 4; 0,41 – 6; 0,73 – 8; 1 – 12 болады. Координациялық сандар катион радиусының Rк, анион радиусына Ra қатынасына байланысты (Rk:Ra). Иондардың радиустарын біліп – әр құрылымның координациялық санын білуге болады(1 кесте).
Кристаллографияның маңызды бөлімдерінің бірі кристалдардың физикалық қасиеттерін зерттейтін кристаллофизика екені жоғарыда айтылды. Кристаллографияның барлық бөлімдері әсіресе кристаллохимия мен кристаллофизиканың практикалық маңызы өте зор.
1 кесте
Координациялық сандар
Не нашли, что искали? Воспользуйтесь поиском: