
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Буферные системы крови
Все процессы в организме животных могут происходить только при строго определенных концентрациях водородных ионов. Даже незначительное смещение реакции внутренней среды в кислую или щелочную сторону вызывает изменение активности ферментов и в связи с этим нарушение закономерного течения биохимических процессов. Смещение рН крови -на 0,5 единицы приводит к агонии. Принятые допустимые физиологические колебания рН крови не выше 0,05—0,07 единицы.
В процессе обмена веществ непрерывно образуются промежуточные продукты окисления, представленные различными кислотами, среди которых значительную долю составляет угольная кислота. В кровь всасываются из пищеварительного тракта различные кислоты, преимущественно органические (кислые продукты кормов и продукты брожения углеводов). Особенно много кислот образуется в тканях в результате распада и окисления фосфорных эфиров углеводов, нуклеотидов и других фосфор- и серосодержащих соединений с образованием соответственно Н3РО4 и H2SO4. Усиленное образование кислореагирующих продуктов наблюдается при нарушении углеводно-липидного и белкового обмена, когда в крови в больших количествах появляются ацетоуксусная, γ-оксимасляная кислоты и др.
Щелочнореагирующие соединения (аммиак, креатин, некоторые аминокислоты и др.) также постоянно образуются в организме. Однако кислоты и основания, образующиеся в организме и поступающие извне, попадая в кровь, не изменяют ее рН, благодаря наличию в ней регуляторных механизмов. Эти механизмы основаны на действии буферных систем и органов выделения.
В процессе развития животных активная реакция крови заметно изменяется. Так, рН крови эмбрионов в начальные периоды развития около 6,0, а к концу эмбриогенеза составляет 6,5—6,8. В постнатальный период этот показатель постепенно возрастает и только через несколько месяцев приобретает величину, характерную для взрослых особей. Ниже показаны значения рН крови у разных видов животных:
| Вид животных | рН | Вид животных | рН |
| Лошадь Корова Овца Коза | 7,20—7,60 7,36—7,50 7,40—7,58 7,40—7,65 | Свинья Кролик Собака Птица | 7,85—7,95 7,33—7,40 7,30—7,46 7,20—7,50 |
При заболеваниях животных рН крови может изменяться. Так, например, при септических заболеваниях и пневмониях активная реакция крови смещается в щелочную сторону (рН 7,7—7,9). При нефритах, перитонитах и других заболеваниях также происходит изменение рН крови, но менее значительно, чем при вышеназванных заболеваниях.
Поддержание рН крови, как отмечалось выше, обеспечивается буферными системами и специальными физиологическими механизмами, находящимися под контролем центральной нервной системы. Буферные системы начинают проявлять свое действие в ранние периоды онтогенеза, однако окончательное их становление происходит в течение первых месяцев постнатальной жизни, после чего они прочно обеспечивают постоянство концентрации водородных ионов в крови.)
Сила буферных систем крови (буферная емкость) очень велика. Об этом свидетельствует тот факт, что для смещения рН крови к ней надо добавить в 320 раз больше кислоты, чем к такому же количеству воды.
В крови имеются как органические, так и минеральные буферные системы. К первым относятся гемоглобиновый и оксигемоглобиновый буфер эритроцитов, белки плазмы крови, аминокислоты и в небольшом количестве сочетания органических кислот (промежуточные продукты обмена) и их солей. К числу минеральных буферных систем относятся гидрокарбонатный буфер и в меньшей мере фосфатный.
Гидрокарбонатная буферная система крови состоит из сочетания СО2, Н2СО3, NaHCO3 и Na2CO3, находящихся между собой в следующих 'соотношениях (объемные % СО2) — 2,7: 1: 47: следы. Образующиеся и поступающие в организм кислоты взаимодействуют с гидрокарбонатом натрия, в результате чего они превращаются в соответствующие соли, а их катион водорода связывается анионом гидрокарбоната, образуя слабодиссоциирующую угольную кислоту. В легких угольная кислота, куда она доставляется из тканей кровью, разлагается на воду и углекислый газ. Последний удаляется из организма с выдыхаемым воздухом:
С02
NaHCOo + Na+ -> Na+ + Н2CO3/
Н2О
(кислота)
Второй компонент гидрокарбонатной буферной системы (угольная кислота) будет нейтрализовать попадающие извне или образующиеся в организме анионы гидроксила:
Н2СО3+ОН- - Н20 + НСО3-
(основание)
Как в первом, так и во втором случае исходная реакция крови не изменяется при поступлении в нее кислых или щелочных эквивалентов до тех пор, пока в ней есть буферные вещества.
Следовательно, для поддержания постоянства рН крови необходим определенный запас гидрокарбоната и других щелоч-нореагирующих веществ в ней, называемый резервной щелочностью. Резервная щелочность определяется по методу Д. Д. Ван-Слайка и выражается количеством миллилитров выделяющейся СО2 на 100 мл плазмы (СО2 образуется из гидрокарбоната натрия, находящегося в плазме и разрушаемо
го более сильной, чем угольная, кислотой). Резервную щелоч. ность можно выражать также кислотной емкостью крови, т. е. количеством миллиграммов щелочи, идущей на титрование избытка кислоты, которую добавляют к крови (расчет ведется на 100 мл крови и поэтому выражается мг% щелочи).
Определение резервной щелочности имеет диагностическое значение, так как этот показатель может изменяться при многих патологических состояниях животных. В норме после тяжелой работы он может уменьшаться почти на 50%, а в период покоя быстро приходит к норме. Ниже представлена резервная щелочность крови животных:
Вид животных Резервная щелоч- Кислотная
ность, объемные % емкость, мг %
Лошади 56—80 420—640
Коровы 50—67 540—600
Овцы 440—540
Свиньи 47—59 450—660
Кролики 45—58 480—680
Куры 35—48
Понижение щелочного резерва крови называют ацидозом, что наблюдается при кетозах, сердечной недостаточности, патологических изменениях в легочных альвеолах, при рахите и некоторых других болезнях. Ацидоз может быть компенсированным, когда он не сопровождается изменением рН крови и некомпенсированным. Пои некомпенсированном ацидозе в организме накопляется столько кислот, что они не могут быть нейтрализованы буферными системами крови, в результате чего ее рН смещается, в кислую сторону.
При противоположном ацидозу состоянии — алколозе — в крови повышается содержание гидрокарбонатов, избыток которых выделяется с мочой, приобретающей слабощелочной характер. Алкалоз развивается при сильной рвоте, гипервентиляции легких, при отравлении окисью углерода, при некоторых инфекционных заболеваниях, сопровождающихся лихорадкой.
Неорганический фосфатный буфер имеет большое значение в клетках различных тканей и относительно невелика его роль в крови, где концентрация неорганических фосфатов не превышает 3—4 мг%. Более существенное значение, чем буферные системы крови, имеют органические фосфаты — гексозофосфа-ты, триозофосфаты, нуклеозидфосфаты и др. Перечисленные вещества своими кислотными остатками могут связывать различные катионы (натрия, калия) и способствовать постоянному значению рН.
^Буферное действие белков плазмы невелико (10 % буферной емкости крови), тогда как гемоглобин эритроцитов — важнейшая буферная система крови, составляющая около 70 % буферной емкости последней^ Действие гемоглобина как буфера очень тесно связано сего функцией в процессе дыхания. Гемоглобин является белком со свойствами слабой кислоты, образующей неустойчивые соли с калием. Под влиянием угольной кислоты (и других продуктов кислого характера) при прохождении крови через капилляры тканей соль гемоглобина разрушается с образованием эквивалентного количества калиевой соли соответствующей кислоты (преимущественно гидрокарбоната калия) и свободного гемоглобина (Н—НЬ). В капиллярах альвеол легких гемоглобин превращается в оксигемоглобин (Н—НЬОо). Последний является относительно сильной органической кислотой, поэтому он отбирает от гидрокарбоната катион калия, в результате чего выделяется более слабая, чем оксигемоглобин, угольная кислота. Освобождающаяся угольная кислота под влиянием карбоангидразы эритроцитов расщепляется на воду и углекислый газ, выделяемый легкими из организма. В свою очередь образовавшаяся калиевая соль оксигемоглобина (К—НЬО2) переносится кровью к капиллярам тканей, где оксигемоглобин от дает кислород и превращается в соль слабой кислоты (К—НЬ). И снова эта соль разрушается образующейся в процессе обмена веществ угольной кислотой. Возникающий при этом гидрокарбонат калия (КНСОз) и свободный гемоглобин (Н—НЬ) не влияют сколько-нибудь значительно на запас свободных ионов водорода в крови, т. е. на рН внутренней среды организма. Описанный процесс связывания Н4- ионов в организме при помощи гемоглобинового буфера можно иллюстрировать следующей схемой:

Таким образом выделение СО2 из гидрокарбонатов крови и присоединение кислорода к гемоглобину в легких увязаны в единый процесс. Следовательно, гемоглобин выполняет не только роль переносчика кислорода, но и оказывает существенное влияние на связывание углекислоты в тканях и выделение ее в легких.
Основное количество углекислоты переносится из тканей в легкие при участии катионов эритроцитов (калий), связанных е гемоглобином, и только небольшая ее часть — при помощи катионов плазмы (натрий). Часть углекислоты может присо
единяться к гемоглобину непосредственно через свободные ам-иногруппы при помощи карбаминовой связи, образуя карбогемоглобин:
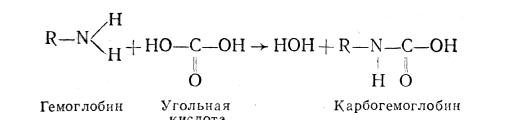
Карбогемоглобин— очень нестойкое соединение и в капиллярах легочных альвеол диссоциирует с отщеплением газообразной угольной кислоты (СО2). Предполагается, что около 15 % всей выделяемой в полость альвеол углекислоты приносится в легкие кровью в форме карбогемоглобина.
Указанные выше процессы происходят в эритроцитах крови и сопровождаются миграцией аниона НСОз из плазмы в эритроциты и обратно. Сохранению постоянства соотношения между анионами и катионами плазмы и эритроцитов в данных условиях способствует синхронный переход из эритроцитов в плазму и в обратном направлении анионов хлора вместо поглощаемых (в тканях) или удаляемых (в легких) анионов HCOJ. Синхронная миграция анионов хлора и гидрокарбоната сопряжена с сохранением нормального физиологического состояния мембран эритроцитов и находящихся в них систем активного переноса. Активный транспорт ионов через мембраны сопровождается тратами энергии (АТФ), источником которой явля ются процессы гликолиза в эритроцитах.
Не нашли, что искали? Воспользуйтесь поиском: