
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Роль полиеновых ВЖК.
1. Повышают растворимость ХС (активируют превращения ХС в желчные кислоты, копростанол).
2. Обеспечивают нормальное состояние кровеносных сосудов (способствуют образованию большого количества простациклинов).
3. Эйконол, полученный из ткани морских рыб, содержащих тимнодоновую и докозогексановую кислоты – препарат для лечения атеросклероза.
4. Стимулируют иммунитет (повышают устойчивость к инфекционным заболеваниям, рентгеновскому облучению).
Особенности:
1. Протекает в цитоплазме.
2. У человека происходит синтез только пальмитиновой кислоты.
3. Принимает участие АПБ – полиферментный комплекс, состоящий из 6 ферментов.
4. Необходимо участие реакций карбоксилирования, СО2, АТФ, НАДФ∙Н2.
Удлинение пальмитиновой кислоты происходит с участием ацетил-КоА, с образованием стеариновой кислоты. В печени и в тканях мозга из стеариновой кислоты образуются ВЖК с длинной углеродной цепью от С20 до С24, необходимых для образования глико- и сфинголипидов. Из ненасыщенных жирных кислот в организме синтезируется только олеиновая в результате дегидрирования стеариновой кислоты (десатурация) – под влиянием ферментов десатураз, которые могут образовывать двойные связи только у 9 углеродного атома, ω-3 и ω-6 не синтезируются в организме и обязательно должны поступать с пищей.

 8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
8.8. Биосинтез нейтральных жиров (триацилглицеринов). Регуляция. процессов. Ожирение, причины.
Ожирение – полигенное заболевание, сопровождающееся накопление ТАГ в адипоцитах, которое является фактором риска развития инфаркта миокарда, инсульта, СД, гипертонической и желчнокаменной болезни.
Ожирение бывает:
1. первичное – оно развивается в результате алиментарного дисбаланса – избыточное калорийное питание по сравнению с расходованием энергии.
Причины: - генетические нарушения до 80%
- состав и количество потребляемой пищи
- система питания в семье
- уровень физической активности
- психологические факторы
Рассмотрим генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми. У людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм. Возможно разное соотношение аэробного и анаэробного гликолиза. Анаэробный гликолиз (как менее эффективный) «сжигает» гораздо больше глюкозы, в результате снижается переработка в жиры.
У человека обнаружен ген ожирения. Продуктом экспрессии этого гена служит белок лептин, который содержит 167 аминокислотных остатков, взаимодействует с рецептором гипоталамуса, в результате снижается секреция нейропептида У, стимулируя пищевое поведение. У 80% больных концентрация лептина в крови тучных людей больше в 4 раза чем у нормы.
2. вторичное ожирение – ожирение развивающееся в результате какого-либо основного заболевания, чаще эндокринного. Например Иценко-Кушинга, гипофиз, гипоталамуса и др.
Нейтральные жиры.
В их состав входит 3х атомный спирт глицерин и высшие жирные кислоты: олеиновая кислота 55%, пальмитиновая 20%, линолевая 10%.

 1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..
1.9. Белки, биологическая роль. Нормы белка в питании для детского организма. Азотистый баланс, коэффициент изнашивания, физиологический минимум. Заменимые и незаменимые аминокислоты. Биологическая ценность белков. Белковая недостаточность. Квашиоркор..
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот, связанных пептидными связями, - являются носителями жизни. Роль белков: транспортная, защитная, каталитическая, структурная, сократительная, регуляторная, рецепторная, энергетическая.
Состояние белкового обмена организма зависит не только от количества принимаемого белка, но и от его качественного состава. Те белки, которые по аминокислотному составу близки к аминокислотному составу организма, лучше подвергаются гидролизу в ЖКТ, т.е. степень их усвоения большая. Эти белки являются биологически более ценными. Они содержат более полный ассортимент незаменимых аминокислот. Под биологической ценностью индивидуального белка понимают его относительно питательную ценность по сравнению со стандартным белковым препаратом с учетом фактора перевариваемости и аминокислотного состава. Стандартным белковым препаратом, содержащим все незаменимые аминокислоты и легко перевариваемым, является, например лактальбумин. Белки, не содержащие какую-либо незаменимую аминокислоту, не обладают биологической ценностью. Растительные белки менее ценны, чем животные (мясо, рыба, молоко и т.д.), так как бедны лизином, метионином и триптофаном, а также труднее перевариваются. В организме могут синтезироваться только некоторые аминокислоты (заменимые), а те которые не синтезируются, называются незаменимыми. Для детей до 3-месячного возраста их 10: лейцин, изолейцин, лизин, треонин, триптофан, фенилаланин, гистидин, цистин, аргинин, валин. У взрослого организма 8 аминокислот являются незаменимыми (аргинин и гистидин – условно заменимые).
Основная масса азота в пище приходится на белки. При обмене белка, содержащийся в нем азот выделяется из организма в виде азотистых веществ. Для изучения и понимания хода и состояния обмена белков большое значение имеет определение азотистого баланса – это разница между количеством поступившего в организм азота и выведенного в виде конечных азотистых продуктов.
Виды азотистого баланса:
«положительный» – если азота выведено меньше, чем введено, т.е. азот задерживается в организме (в норме это имеет место у беременных, в растущем организме). При этом происходит накопление белков в тех или иных органах и тканях.
«нулевой» – азотистое равновесие.
«отрицательный» – если азота выведено больше, чем введено. Это значит, что в организме идет распад белков органов и тканей (сахарный диабет, ожоги, злокачественные новообразования и др.), который не компенсируется белками пищи. Он наблюдается при заболеваниях, связанных с усиленным распадом белков тканей, в старческом возрасте.
Коэффициент изнашивания – это результат ежесуточного распада тканевого белка, который равняется 23,2 г. Определен он был на добровольцах, у которых на 8-10 день безбелковой диеты начинает выделяться постоянное количество азота (53 мг в сутки на 1 кг массы тела).
Определив физиологический минимум белка, равный 30-45 г в сутки, при котором в организме устанавливается азотистое равновесие, ученые научно обосновали и рекомендовали суточную потребность белка, равную 100-120 г. Одинаково она зависит от многих факторов: возраста, вида выполняемой работы, физиологических и патологических состояний и т.д. Потребность в белке у детей: 1-3 года – 4,0 г/кг массы, 11-13 лет – 2,5 г/кг массы, 14-17 лет – 1,8 г/кг массы.
При тяжелых формах пищевых дистрофий, например, при «квашиоркоре» (в переводе «золотой или красный мальчик») – заболевании, которое распространено среди детей развивающихся стран, наблюдаются тяжелые поражения печени, остановка роста, отечность, атония мышц, анемия, резкое снижение сопротивляемости организма инфекциям. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Болезнь часто заканчивается летальным исходом.
При белковой недостаточности наблюдается резкое снижение интенсивности процессов дезаминирования, трансаминирования, биосинтеза аминокислот и синтеза мочевины в печени. Эти нарушения обусловлены нарушением ферментативных функций печени и других органов. Следствием их являются накопление аминокислот в крови, экскреция с мочой свободных аминокислот (до 10-20 г/сут, в норме – 1г/сут) и резкое снижение образования и выделения мочевины с мочой.
Аминоацидурия – дефект белков одной из транспортных систем аминокислот в почках, где происходит их реабсорбция, сопровождающийся потерей их с мочой в 3-5 раз больше нормы.
Цистинурия – дефект белка, транспортирующего цистин, приводит к повышенному выделению с мочой преимущественно цистина и образованию цистиновых камней в почках.
Кетонурия – болезнь, сопровождающаяся появлением мочи с запахом ''кленового сиропа'', является следствием недостаточности декарбоксилазы кетопроизводных аминокислот, т.е. валина, лейцина и изолейцина. В результате нарушения окислительного декарбоксилирования происходит повышение содержания в крови этих аминокислот и их кетопроизводных, а также выделение их с мочой. Моча таких больных имеет характерный запах ''кленового сиропа''. Клинически у таких детей наблюдается рвота, периодические судороги, мышечная ригидность.
2.9.Особенности процессов переваривания белков у детей. Эндопептидазы – пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Экзопептидазы: карбоксипептидаза, аминопептидазы, дипептидазы. Роль соляной кислоты в процессе пищеварения.
Переваривание белков в ЖКТ следует рассматривать как начальный этап обмена веществ, при котором белки лишаются видовой специфичности и в виде аминокислот усваиваются организмом. Фермент ЖКТ осуществляет поэтапное расщепление пептидных связей белковой молекулы.
Протеазы, гидролизующие пептидные связи внутри белковой молекулы относятся к эндопептидазам: пепсин, ренин (у детей) гастриксин, трипсин, химотрипсин, эластаза – синтезируются в неактивной форме. Механизм активирования связан с отщеплением концевого пептида, приводящее к формированию трехмерной структуры и образованию активного центра ферментов. Трипсин разрывает пептидные связи, образованные основными аминокислотами: лизином и аргинином, пепсин – между циклическими аминокислотами, ренин створаживает молоко.
Ферменты, гидролизующие пептидную связь, образованную концевыми аминокислотами относятся к экзопептидазам: карбоксипептидазы синтезируются в виде предшественников в поджелудочной железе, содержат Zn, разрывают пептидные связи, образованные ароматическими аминокислотами.
Переваривание белков начинается в желудке. Большую роль в этом процессе занимает соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов – гастринов, которые вызывают секрецию соляной кислоты (образуется в обкладочных клетках желудочных желез) и профермента пепсиногена. Под действием соляной кислоты происходит денатурация белков пищи, не подвергшихся термической обработке. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Она активирует пепсиноген и создает оптимум рН для действия пепсина.
Желудочное содержимое (химус) в процессе перевариваня поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина (рН резко возрастает от 1,5-2,0 до 7,0).
Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Под влиянием протеолитических ферментов образуются аминокислоты, которые всасываются в кишечнике, либо диффузно, либо путем активного транспорта.
3.9.Гниение белков в толстом кишечнике. Образование, всасывание в кровь и обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
Гниение белков в кишечнике: под влиянием микрофлоры нижнего отдела кишечника некоторые аминокислоты могут подвергаться превращениям до аминов, жирных кислот, спиртов, фенолов, сероводорода и др.
Общее направление этих реакций:
При декарбоксилировании аминокислот возможно образование соответствующих нередко ядовитых аминов.
При дезаминировании возникают насыщенные и ненасыщенные кислоты, кетокислоты, оксикислоты.
Путресцин образуется при декарбоксилировании орнитина, а кадаверин – из лизина. Они относятся к группе трупных ядов. Выводятся из организма через почки с мочой почти в неизменном виде. Выделение путресцина и кадаверина с мочой наблюдается при холере, дизентерии и т.д.
Фенол и крезол образуются из тирозина. После всасывания они обезвреживаются в печени. Происходит это либо за счет связывания с Н2SО4, либо с глюкуроновой кислотой. В результате образуются парные серные-, фенол- или крезолглюкуроновые кислоты. Они называются еще эфиро-серными кислотами и являются постоянными составными частями мочи. Серная кислота присоединяется в виде активной формы, формируя фосфоаденин фосфосульфат (ФАФС), глюкуроновая кислота – уридиндифосфат глюкуроновой кислоты (УДФГК).
Индол и скатол образуется при декарбоксилировании из триптофана. Они обусловливают специфический запах кала, являются ядовитыми веществами и обезвреживаются в печени. Индол связывается в виде эфирсерной кислоты калиевая соль этой кислоты получила название животного индикана, который выводится с мочой и по его количеству судят не только о скорости процесса гниения, но и о функциональном состоянии печени.
Пути использования аминокислот после всасывания:
1. Синтез специфических белков тканей, плазмы крови, ферментов, гормонов.
2. Синтез углеводов (глюконеогенез).
3. Синтез липидов.
4. Синтез гистамина, серотонина, креатина, порфиринов, холина, адреналина, пуриновых, пиримидиновых нуклеотидов.
5. Синтез мочевины.
6. Оставшиеся неиспользованные аминокислоты подвергаются распаду с выделением энергии (10-15%).
Общие пути распада аминокислот:
Декарбоксилирование;
Трансаминирование;
Дезаминирование;
4.9.Трансаминирование аминокислот. Роль трансаминаз(аланинтрансаминаза,аспартаттрансаминаза),кофермента-пиридоксальфосфата. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови в диагностике инфаркта миокарда, заболеваниях печени.
Трансаминирование – процесс переноса аминогруппы с α-аминокислоты на кетокислоту при участии ферментов трансаминаз (В6 – фосфопиридоксаль). Этому процессу подвергаются все аминокислоты, кроме лизина, треонина и пролина.

Реакцию трансаминирования катализируют высокоактивные аминотрансферазы: аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), которые обладают субстратной специфичностью.
АЛТ и АСТ – органоспецифические ферменты, в норме в крови их активнрсть равна 5-40 ЕД/л, т.е. активность трансаминаз сравнительно низкая. При заболеваниях, сопровождающихся деструкцией (некрозом) клеток, происходит выход ферментов в кровь и повышение их активности. Определение активности АЛТ и АСТ имеет большое диагностическое значение. Для дифференциальной диагностики заболеваний печени и сердца определяют соотношение активности АСТ/АЛТ в сыворотке крови – «коэффициент де Ритиса», который в норме составляет 1,33±0,42.
При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ – в2-4 раза. «Коэффициент де Ритиса» уменьшается примерно до 0,6. Особенно важное значение для диагностики имеет повышение активности АЛТ при безжелтушных формах вирусного гепатита. У детей при гепатитах активность АЛТ возрастает еще в дожелтушный период развития болезни. Однако, при церрозе печени «Коэффициент де Ритиса» приближается к 1,0, что свидетельствует о некрозе клеток, при котором в кровь выходят обе фракции (цитоплазматическая и митохондриальная).
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – в 1,5 -2,0 раза. Значение «Коэффициента де Ритиса» резко возрастает. Инфекционные и токсические миокардиты характеризуются повышением АСТ, это же самое наблюдается при операциях на сердце.
При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не возрастает.
5.9.Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот(связь с трансаминированием). Дезаминирование – процесс потери аминокислотой аминогруппы. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
1. Окислительное дезаминирование.

 NН
NН
СООН – СН2 – СН2 – С – СООН


 НООС–СН2- СН2 - СН – СООН
НООС–СН2- СН2 - СН – СООН
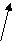 NН2
NН2


 О
О
ГДГ +НОН СООН-СН2-СН2-С-СООН


 глутаминовая кислота иминоглутарат NН3 + -
глутаминовая кислота иминоглутарат NН3 + -
α-кетоглутаровая кислота
 НАД
НАД
НАДН2
Остальные аминокислоты подвергаются непрямому дезаминированию.
2. Непрямое дезаминирование – это процесс дезаминирования путем трансаминирования.
Основные источники аммиака в детском организме. Роль глутамина в обезвреживании и транспорте аммиака. Судьба аммиака в организме. Биосинтез мочевины(орнитиновый цикл). Нарушение синтеза и выведения мочевины. Гипераммониемия.
Аммиак в организме образуется в результате дезаминирования аминокислот, биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение). Концентрация аммиака в крови в норме – 0,4-0,7мг/л. Это токсичное соединение, поэтому аммиак не накапливается, а вступает в реакцию с глутаминовой или аспарагиновой кислотами с образованием индифферентной транспортной формы – глутамина или аспарагина.
+NН3
 НООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН
НООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН


NН2 АТФ NН2
-Н 2О
глутаминовая кислота глутамин
+NН3
 НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН
НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН

 АТФ
АТФ
NН2 -Н 2О
NН2
аспарагиновая кислота аспарагин
В почках глутамин под влиянием глутаминазы расщепляется с образованием аммиака, идущего на нейтрализацию кислых соединений с образованием аммонийных солей. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов (Na+, K+) для поддержания осмотического давления. Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, белков, глюкозы. Также источниками образования аммиака служат процессы:
- дезаминирования биогенных аминов;
- распад пиримидиновых оснований (урацил, тимин, цитозин);
- дезаминирования аминокислот;
- дезаминирования пуриновых оснований (гуанина и аденина).
Пути использования аммиака в организме:
1. Синтез аминокислот из соответствующих кетокислот:
АТФ
 СН3-С-СООН + NН3 СН3-СН-СООН
СН3-С-СООН + NН3 СН3-СН-СООН



О NН2
ПВК аланин
2. Синтез аммонийных солей в почках.
3. Синтез пуриновых и пиримидиновых нуклеотидов.
4. Синтез мочевины – основной путь обезвреживания аммиака.
ГИПЕРАММОНИЕМИЯ.
Повышение содержания аммиака в крови до 6000мкмоль/л (норма-60мкмоль/л) оказывает токсическое действие на организм.
Причины:
1. генетический дефект ферментов орнитинового цикла в печени;
2. вторичное поражение печени в результате цирроза, гепатита и др.
Симптомы: тошнота, повторяющаяся рвота, потеря сознания, отек мозга, отставание умственного развития. Все симптомы гипераммониемии – проявление действия аммиака на ЦНС.
Для диагностики производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активность ферментов печени.
Еще в прошлом веке русские ученые М.В. Ненцкий и С.С. Салазкин показали, что в печени происходит образование мочевины из углекислого газа и аммиака.
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.

В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных
продуктов - аммиака;
2. синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется. Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут. При повышении количества потребляемых с пищей белков увеличивается выделение мочевины.
7.9. Обмен фенилаланина и тирозина. Врожденные нарушения обмена аминокислот. Фенилкетонурия, алкаптонурия, альбинизм причины проявления, их профилактика. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, γ-аминомасляная кислота. Образование, функции. Инактивация биогенных аминов.
Причиной нарушений в обмене отдельных аминокислот служит полное или частичное выключение определенной ферментативной активности. При этом врожденном дефекте идет накопление большого количества промежуточных или побочных продуктов, оказывающих токсическое действие на организм, особенно на ЦНС. Вот почему, прежде всего, поражаются дети раннего возраста с последующим нарушением психической деятельности.
Фенилкетонурия – это наследственное заболевание, связанное с отсутствием фермента фенилаланингидроксилазы, в связи с чем фенилаланин превращает не в тирозин, а в фенилпировиноградную кислоту (ФПВК). При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме-1,0-2,0мг/дл), в моче – в 100-300 раз (норма – 30 мг/дл). Наиболее тяжелые проявления – нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. Эти проявления связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина. При отсутствии лечения больные не доживают до 30 лет. Заболевание наследуется по аутосомно-рецессивному типу.



 Фенилаланин фен-ала тирозин
Фенилаланин фен-ала тирозин
гидроксилаза
ФПВК
Из аминокислоты тирозина образуются: тироксин, норадреналин, адреналин, меланин и др. При отсутствии ферментов, расщепляющих тирозин, наблюдается следующая патология:
Альбинизм – наследственное заболевание, связанное с отсутствием фермента тирозиназы. Тирозин не превращается в дезоксифенилаланин (ДОФА), следовательно, не образуется пигмент меланин. Клиническое проявление – отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь.
тирозин
 |  | ||
 ДОФА
ДОФА
 дофамин гомогентизиновая кислота
дофамин гомогентизиновая кислота
 |  |  | |||
меланин норадреналин ацетоуксусная фумаровая
 кислота кислота
кислота кислота
адреналин
Алкаптонурия («черная моча») – заболевание, связанное с отсутствием фермента диоксигеназы, расщепляющего гомогентизиновую кислоту. Она выводится с мочой и при соприкосновении с воздухом моча приобретает темную окраску. Клиническими проявлениями болезни также являются пигментация соединительной ткани (охроноз) и артрит.
Нуклеопротеины. Переваривание в желудочно-кишечном тракте. Распад нуклеиновых кислот (нуклеазы).Распад пуриновых нуклеотидов. Подагра, применение аллопуринола для лечения подагры. Синдром Леша-Нихана. Представление о биосинтезе пуриновых нуклеотидов. Инозиновая кислота как предшественник адениловой и гуаниловой кислот.
Нуклеопротеины – сложные белки, состоящие из белков и нуклеиновых кислот. Существует два типа нуклеопротеинов, которые отличаются друг от друга по составу, размерам и физико-химическим свойствам: дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП).
Нуклеопротеины пищи подвергаются перевариванию в ЖКТ, образуя ряд низкомолекулярных продуктов, всасывающихся в тонком кишечнике.
1 этап – это отщепление нуклеиновой кислоты от белковой части нуклеопротеина. Этот разрыв связи между белком и простетической группой происходит как в желудке, так и в кишечнике. В желудке этот процесс происходит под действием пепсина, в кишечнике – под действием трипсина. Затем белок в ЖКТ подвергается обычным превращениям.
Расщепление нуклеиновых кислот, содержащихся в пище, происходит в результате переваривания в тонком кишечнике под действием нуклеаз: РНК-азы и ДНК-азы. Всасывание продуктов гидролиза нуклеиновых кислот происходит в виде нуклеотидов и нуклеозидов, а также в виде азотистых оснований, пентозы и остатка фосфорной кислоты.
Аденозин и гуанозин, которые образуются при гидролизе пуриновых нуклеотидов, подвергаются ферментативному распаду с образованием конечного продукта – мочевой кислоты, которая выводится с мочой из организма.

Гиперурикемия – повышение в плазме крови концентрации мочевой кислоты. Вследствие гиперурикемии может развиться подагра.
Подагра – заболевание, вызванное нарушением обмена нуклеиновых кислот. В хрящах, сухожилиях, в суставных сумках, иногда в почках, коже, мышцах откладываются кристаллы мочевой кислоты и уратов. Вокруг этих отложений образуется воспаление и грануляционный вал, который окружает омертвевшую ткань, при этом образуются подагрические узлы - тофусы (в суставах пальцев рук, ног, в хрящах ушной раковины), что сопровождается деформацией и болезненностью пораженных суставов. К характерным признакам подагры относятся повторяющиеся приступы острого воспаления суставов (чаще всего мелких) – острого подагрического артрита. Обычно больные склонны к атеросклерозу и гипертонии. В их крови наблюдается большая концентрация мочевой кислоты – гиперурикемия. В течение нескольких дней перед приступом подагры увеличивается выделение воды и хлорида натрия с мочой, т.е. сдвигается водно-солевой баланс. Вследствие этого возрастает концентрация мочевой кислоты в крови и отложение ее в тканях. Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе фосфорибозилдифосфата (ФРДФ) синтетазы или гипоксантингуанин- или аденинфосфорибозилтрансфераз. К другим характерным проявлениям относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях.
Синдром Леша-Нихена – тяжелая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой. Проявляется только у мальчиков. Кроме симптомов подагры наблюдаются церебральные параличи, нарушение интеллекта, попытки наносить себе раны (укусы губ, пальцев). Связана болезнь с дефектом фермента гипоксантин-гуанин-фосфорибозилтрансферазы, которая катализирует превращение гипоксантина и гуанина в гуанинимонофосфат (ГМФ), поэтому они превращаются в мочевую кислоту. В первые месяцы жизни неврологические расстройства не обнаруживаются, но на пеленках отмечают розовые пятна, вызванные присутствием в моче кристаллов мочевой кислоты. При отсутствии лечения больные погибают в возрасте до 10 лет из-за нарушения функции почек.
Основной препарат для лечения гиперурикемии – аллопуринол (структурный аналог гипоксантина).
Биосинтез пуриновых мононуклеотидов.
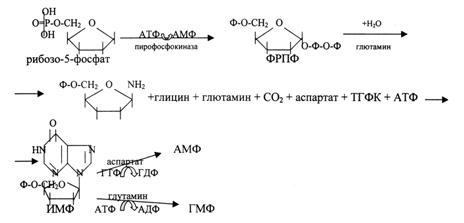
Первоначальным соединением синтеза служит Д-рибозо-5-фосфат, который является продуктом пентозофосфатного цикла и на который переносится пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, который является донором NН2-группы в результате чего образуется β-5-фосфорибозил-амин. Эта стадия становится ключевой в синтезе пуринов. Затем присоединяется молекула глицина к свободной NН2-группе β-5-фосфорибозил-амина с образованием глицинамидрибонуклеотида. Еще через несколько стадий образуется первый пуриновый нуклеотид инозинмонофосфат (ИМФ), из которого затем синтезируются остальные нуклеозидфосфаты.
Схема:
9.9.Представление о распаде и биосинтезе примидиновых нуклеотидов. Применение антифолатов для лечения злокачественных опухолей у детей.
Биосинтез пиримидиновых нуклеотидов
Первоначальными соединениями этого процесса являются карбамоилфосфат и аспарагиновая кислота. Из них через длинную цепь реакций образуется уридинмонофосфат (УМФ) и остальные пиримидиновые нуклеотиды.

Распад пиримидиновых нуклеотидов.
Начальные этапы этого процесса катализируются специфическими ферментами. Конечные продукты: СО2, NН3, мочевина, β-аланин, β-аминоизомасляная кислота. β-аланин используется для синтеза дипептидов мышц – карнозина и ансерина или выделяется с мочой.

10.9. Сахарный диабет. Типы, причины возникновения и основные проявления нарушения метаболизма при сахарном диабете:обмена углеводов, липидов, аминокислот. Механизмы возникновения гипергликемии, глюкозурии, кетонемии, кетонурии, гиперхолестеролемии и других нарушений при сахарном диабете. Гликозилированные белки. Их значение при возникновении ангиопатии.
1.10. Кровь, биологическая роль, физико-химические свойства. Органические и неорганические компоненты крови у детей.
КРОВЬ – жидкая подвижная ткань, обеспечивающая постоянство внутренней среды организма.
Функции крови:
- Дыхательная – Hb транспортирует кислород и углекислый газ;
- Транспортная – перенос питательных веществ, промежуточных и конечных метаболитов обмена веществ;
- Выделительная функция – удаляет конечные продукты обмена (мочевина, креатинин, мочевая кислота и др.);
- Защитная – участвует в иммунитете (иммуноглобулины), в процессе свертывания (фибриноген);
- Регуляторная – осуществляет транспорт гормонов к органам мишеням;
- Терморегуляторная – поддерживает постоянство температуры тела в разных его частях.
Общий объем крови взрослого человека составляет 5-6 л или 7-8% массы тела, у детей эта цифра несколько выше. Кровь состоит из жидкой части плазмы и форменных элементов (эритроциты, лейкоциты и тромбоциты).
Физико-химические свойства крови:
- Поддерживает кислотно-щелочной баланс. В норме рН крови – 7,36-7,4;
- Вязкость крови в 5-6 раз выше вязкости воды;
- Относительная плотность цельной крови – 1,050-1,064;
- Осмотическое давление плазмы крови ≈ 7,6 атм.
Химический состав крови:
1.Белки плазмы (альбумины, глобулины, фибриноген) – 7%;
2.Небелковые компоненты (глюкоза, липиды, аминокислоты, креатин, мочевина, билирубин) – 2%;
3.Неорганические компоненты (NaCl, CaCl2, Na2HРO4) – 0,9%.
2.10.Белки плазмы крови и их биологическая роль. Причины гипер-, гипопротеинемии, диспротеинемии, парапротеинемии. Белки крови: альбумины, глобулины, фибриноген
Содержание общего белка у взрослых – 65-85 г/л, у грудных детей – 41-73 г/л
Функции белков крови:
- Обуславливают онкотическое давление крови;
- Поддерживают постоянство рН крови;
- Обуславливают вязкость крови;
- Осуществляют транспорт нерастворимых в воде веществ (жирные кислоты, билирубин, аспирин и др.);
- Участвуют в иммунитете (γ-глобулины);
- Участвуют в свертывании крови (фибриноген);
- Являются резервом аминокислот (при белковом голодании и др.).
Альбумины: содержание – 40-50 г/л, молекулярная масса – 68-70 тыс. дальтон
Глобулины
Содержание глобулинов в крови – 20-30 г/л. Молекулярная масса – 160-180 тыс. дальтон
Методом электрофореза на бумаге выделены α1, α2, β и γ-глобулиновые фракции.
α и β-глобулины синтезируются в печени, а γ-глобулины - В-лимфоцитами.
α1- глобулины:
- Ингибиторы протеиназ (антитрипсин и т.д.);
- Протромбин
α2- глобулины:
- Церулоплазмин – белок небесно-голубого цвета, транспортирует медь, поддерживая нормальный уровень её в тканях, особенно в печени;
- Гаптоглобины – комплексы белка с гемоглобином. Эти комплексы не могут экскретироваться (высокая м.м.) почками, предотвращается потеря Fe;
- Антитромбин III
- Ретинолсвязывающий белок – транспорт ретинола
β-глобулины:
- Трансферрин – транспорт Fe в различные ткани;
- Фибриноген
γ-глобулины (иммуноглобулины) – антитела
У новорожденных и детей грудного возраста антитела не синтезируются и должны поступать в составе грудного молока.
Фибриноген – 2-4 г/л, молекулярная масса – 330 тыс. дальтон
Гипопротеинемия – уменьшение содержания общего белка крови. Наблюдается при кровотечениях, злокачественных новообразованиях, нарушениях функции почек, печени, голодании и др.
Гиперпротеинемия – повышение содержания общего белка крови.
Относительная гиперпротеинемия связана с потерей воды, а, следовательно, повышением концентрации общего белка (поносы, рвота, сахарный и несахарный диабет, холера, дизентерия).
Абсолютная гиперпротеинемия возникает вследствие повышенного образования белков, например, образование γ-глобулинов при инфекционных заболеваниях.
Диспротеинемии – это изменения в соотношении отдельных белковых фракций.
В норме А/Г=1,5-2,3 (альбумино-глобулиновый коэффициент). Содержание общего белка остается в норме.
Причины:
- Нарушения функций почек, А/Г коэффициент уменьшается за счет потери в большей степени альбуминов;
- Нарушения функций печени. А/Г коэффициент снижается за счет уменьшения синтеза альбуминов и глобулинов;
- Инфекционные заболевания, сопровождающиеся повышением антител.
Парапротеинемии – появление белков, которые не существуют в норме.
- Интерферон – специфический белок, синтезирующийся в организме в результате проникновения различных вирусов;
- С-реактивный белок – появляется в крови в острый период болезни (белок острой фазы) или в период обострения хронического процесса (пневмония, ревматизм и др.);
- Миеломные белки – при миеломной болезни;
- Макроглобулины – при макроглобулинемия Вальденстрема;
Не нашли, что искали? Воспользуйтесь поиском: