
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гемоглобины взрослого человека 1 страница
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
· Гемоглобин А - основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β (2α2β).
· Гемоглобин A2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
· Гемоглобин А1с - гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
· Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2α2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
· Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 γ-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.

Классическим примером наследственной гемоглобинопатии является серповидно-клеточная анемия, широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Гемоглобин S, как показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина: в частности, после отдачи кислорода в тканях он превращается в плохо растворимую дез-окси-форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте. Химический дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с N-конца на валин в β-цепях молекулы гемоглобина HbS. Это результат мутации в молекуле ДНК, кодирующей синтез β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же последовательности и в таком же количестве, как и в нормальном гемоглобине НЬА. Одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития тяжелой наследственнойболезни – серповидно-клеточной анемии. Талассемии, строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез β-цепей, то развивается β-талассемия; при генетическом дефекте синтеза α-цепей развивается α-талас-семия. При β-талассемии в крови наряду с HbA1появляется до 15% НЬА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформациейчерепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму. Механизм изменения формы эритроцитов объяснить пока не удалось.
140. Биосинтез гема и его регуляция. Нарушения синтеза тема. Порфирии.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450. Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.

Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму.

В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты в молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Гидроксиметилбилан может также нефермента-тивно превращаться в уропорфириноген I, который декарбоксилируется в копропорфирино-ген I. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходят заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
Наследственные и приобретённые нарушения синтеза гема, сопровождающиеся повышением содержания порфириногенов, а также продуктов их окисления в тканях и крови и появлением их в моче, называют порфириями ("порфирин" в переводе с греч. означает пурпурный). Наследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за исключением аминолевулинатсинтазы. При этих заболеваниях отмечают снижение образования гема. Поскольку гем - аллостерический ингибитор аминолевулинатсинтазы, то активность этого фермента повышается, и это приводит к накоплению промежуточных продуктов синтеза гема - аминолевулиновой кислоты и порфириногенов. В зависимости от основной локализации патологического процесса различают печёночные и эритропоэтические наследственные порфирии. Эритропоэтические порфирии сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печёночные - в гепатоцитах. При тяжёлых формах порфирии наблюдают нейропсихические расстройства, нарушения функций РЭС, повреждения кожи. Порфириногены не окрашены и не флуоресцируют, но на свету они легко превращаются в порфирины. Последние проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах. В коже на солнце в результате взаимодействия с порфиринами кислород переходит в синглетное состояние. Синглетный кислород вызывает ускорение ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и порфириногены являются нейротоксинами. Иногда при лёгких формах наследственных порфирии заболевание может протекать бессимптомно, но приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы, может вызвать обострение болезни. Индукторами синтеза аминолевулинатсинтазы являются такие известные лекарства, как сульфаниламиды, барбитураты, диклофенак, вольтарен, стероиды, гестагены. В некоторых случаях симптомы болезни не проявляются до периода полового созревания, когда повышение образования β-стероидов вызывает индукцию синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях солями свинца, так как свинец нгибирует аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание их в организм сопровождается симптомами порфирии.
141. Распад гема. Обезвреживание билирубина. Нарушения обмена билирубина—желтухи: гемолитическая, обтурационная, печеночно-клеточная. Желтуха новорожденных.
Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца В ходе реакции образуются линейный тетрапир-рол - биливердин (пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Гем индуцирует транскрипцию гена гемоксигеназы, абсолютно специфичной по отношению к тему. Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Билирубин образуется не только при распаде гемоглобина, не также при катаболизме других гемсодержащю белков, таких как цитохромы и миоглобин. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека - примерно 250-350 мг билирубина. Дальнейший метаболизм билирубина происходит в печени.
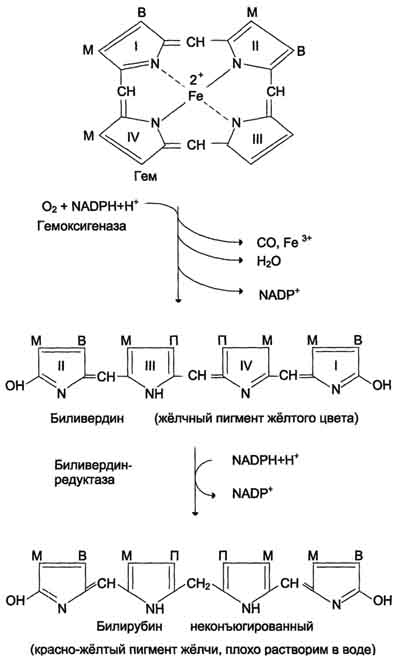
Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Каждая молекула альбумина связывает (или даже 3) молекулы билирубина, одна из которых связана с белком более прочно (более высокое сродство), чем другие. При сдвиге рН крови в кислую сторону (повышение концентрации кетоновых тел, лактата) изменяются заряд, конформация альбумина, снижается сродство к билирубину. Поэтому билирубин, связанный с альбумином непрочно, может вытесняться из центров связывания и образовывать комплексы с коллагеном межклеточного матрикса и липидами мембран. Ряд лекарственных соединений конкурирует с билирубином за высокоаффинный, имеющий высокое сродство центр альбумина.
Поглощение билирубина паренхиматозными клетками печени. Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z. Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке. Лигандин и протеин Z обнаружены также в клетках почек и кишечника, поэтому при недостаточности функции печени они способны компенсировать ослабление процессов детоксикации в этом органе.
Конъюгация билирубина в гладком ЭР. В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты. Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин).
Донором глюкуроновой кислоты служит УДФ-глюкуронат. Специфические ферменты, УДФ-глюкуронилтрансферазы (уридиндифосфоглюкуронилтрансферазы) катализируют образование моно- и диглюкуронидов билирубина.

Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т.е. против градиента концентрации. Активный транспорт является, вероятно, ско-рость-лимитирующей стадией всего процесса метаболизма билирубина в печени. В норме диглюкуронид билирубина - главная форма экскреции билирубина в жёлчь, однако не исключается присутствие небольшого количества моноглюкуронида. Транспорт конъюгирован-ного билирубина из печени в жёлчь активируется теми же лекарствами, которые способны индуцировать конъюгацию билирубина. Таким образом, можно сказать, что скорость конъюгации билирубина и активный транспорт билирубинглюкуронида из гепатоцитов в жёлчь строго взаимосвязаны В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ерментами β-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тет-рапиррольных соединений – уробилиногенов В подвздошной и толстой кишках небольшая часть уробилиногенов снова всасывается, попадает с кровью воротной вены в печеНb. Основная часть уробилиногена из печени в составе жёлчи выводится в кишечник и выделяется с фекалиями из организма, часть уробилиногена из печени поступает в кровь и удаляется с мочой в форме уробилина. В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилина и удаляется с фекалиями. Цвет фекалий обусловлен присутствием уробилина.
Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени. Во всех случаях содержание билирубина в крови повышается. При достижении определённой концентрации он диффундирует в ткани, окрашивая их в жёлтый цвет. Пожелтение тканей из-за отложения в них билирубина называют желтухой. Клинически желтуха может не проявляться до тех пор, пока концентрация билирубина в плазме крови не превысит верхний предел нормы более чем в 2,5 раза, т.е. не станет выше 50 мкмоль/л.
Гемолитическая (надпечёночная) желтуха. Известно, что способность печени образовывать глюкурониды и выделять их в жёлчь в 3-4 раза превышает их образование в физиологических условиях. Гемолитическая (надпечёночная) желтуха - результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Гемолитическая желтуха развивается при исчерпании резервных возможностей печени. Основная причина надпечёночной желтухи - наследственные или приобретённые гемолитические анемии. При гемолитических анемиях, вызванных сепсисом, лучевой болезнью, дефицитом глюкозо-6-фосфатдегидрогеназы эритроцитов, та-лассемией, переливанием несовместимых групп крови, отравлением сульфаниламидами, количество освобождающегося из эритроцитов гемоглобина за сутки может доходить до 45 г (при норме 6,25 г), что значительно увеличивает образование билирубина. Гипербилирубинемия у больных гемолитической желтухой обусловлена значительным повышением (103 - 171 мкмоль/л) в крови концентрации альбуминсвязанного не-конъюгированного билирубина (непрямой билирубин). Образование в печени и поступление в кишечник больших количеств билирубинглюкуронидов (прямой билирубин) ведёт к усиленному образованию и выделению с калом и мочой уробилиногенов и более интенсивной их окраски. Один из главных признаков гемолитической желтухи - повышение содержания в крови не-конъюгированиого (непрямого) билирубина. Это позволяет легко отличить её от механической (подпечёночной) и печёночно-клеточной (печёночной) желтух. Неконъюгированный билирубин токсичен. Гидрофобный, липофильный неконъюгирован-ный билирубин, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клетки и органелл. Это отрицательно сказывается а состоянии ЦНС, вызывая у больных ряд характерных неврологических симптомов.
Желтуха новорождённых. Частая разновидность гемолитической желтухи новорождённых - "физиологическая желтуха", наблюдающаяся в первые дни жизни ребёнка. Причиной повышения концентрации непрямого билирубина в крови служит ускоренный гемолиз и недостаточность функции белков и ферментов печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина. У новорождённых не только снижена активность УДФ-глюкуронилтрансферазы, но и, по-видимому, недостаточно активно происходит синтез второго субстрата реакции конъюгации УДФ-глюкуроната. Известно, что УДФ-глюкуронилтрансфераза - индуцируемый фермент. Одно из неприятных осложнений "физиологической желтухи" - билирубиновая энцефалопатия. Когда концентрация неконъюгированного билирубина превышает 340 мкмоль/л, он проходит через гематоэнцефалический барьер головного мозга и вызывает его поражение.
Печёночно-клеточная (печёночная) желтуха. Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах.Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. Для печёночно-клеточной желтухи характерно то, что вместо преобладающих в норме диглюкуронидов билирубина в поражённой печёночной клетке образуются главным образом моноглюкурониды В результате деструкции печёночной паренхимы образующийся прямой билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе. Экскреция жёлчи также нарушена. Билирубина в кишечник попадает меньше, чем в норме. При печёночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так и обеих его фракций - неконъюгированного (непрямого) и конъюгированного (прямого). Так как в кишечник поступает меньше билирубинглюкуронида, то и количество образующегося уробилиногена также снижено. Поэтому кал гипохоличный, т.е. менее окрашенный. Моча, наоборот, имеет более интенсивную окраску за счёт присутствия там не только уробилинов, но и конъюгированного билирубина, который хорошо растворим в воде и экскретируется с мочой.
Механическая, или обтурационная (подпечёночная) желтуха. Механическая, или обтурационная (подпечёночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной железы или послеоперационным сужением общего жёлчного протока При полной закупорке общего жёлчного протока конъюгированный билирубин в составе желчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать. Поскольку билирубин в кишечник не попадает, продуктов его катаболизма уробилиногенов в моче и кале нет. Кал обесцвечен. Так как нормальные пути экскреции билирубина заблокированы, происходит его утечка в кровь, поэтому в крови больных повышена концентрация конъюгированного билирубина. Растворимый билирубин экскретируется с мочой, придавая ей насыщенный оранжево-коричневый цвет.
142. Диагностическое значение определения билирубина и других желчных пигментов в крови и моче.
При диагностике желтух надо иметь в виду, что на практике редко отмечают желтуху какого-либо одного типа в "чистом" виде. Чаще встречается сочетание того или иного типа. Так, при выраженной гемолитической желтухе, сопровождающейся повышением концентрации непрямого билирубина, неизбежно страдают различные органы, в том числе и печень, что может вносить элементы паренхиматозной желтухи, т.е. повышение в крови и моче прямого билирубина. В свою очередь, паренхиматозная желтуха, как правило, включает в себя элементы механической. При подпечёночной (механической) желтухе, например при раке головки поджелудочной железы, неизбежен повышенный гемолиз как следствие раковой интоксикации и, как следствие, повышение в крови как прямого, так и непрямого билирубина. Итак, гипербилирубинемия может быть следствием избытка как связанного, так и свободного билирубина. Измерение их концентраций по отдельности необходимо при постановке диагноза желтухи. Если концентрация билирубина в плазме <100 мкмоль/л и другие тесты функции печени дают нормальные результаты, возможно предположить, что повышение обусловлено за счёт непрямого билирубина. Чтобы подтвердить это, можно сделать анализ мочи, поскольку при повышении концентрации непрямого билирубина в плазме прямой билирубин в моче отсутствует. При дифференциальной диагностике желтух необходимо учитывать содержание уробилиногенов в моче. В норме за сутки из организма выделяется в составе мочи около 4 мг уробилиногенов. Если с мочой выделяется повышенное количество уробилиногенов, то это - свидетельство недостаточности функции печени, например при печёночной или гемолитической желтухе. Присутствие в моче не только уробилиногенов, но и прямого билирубина указывает на поражение печени и нарушение поступления жёлчи в кишечник.
| Желчные пигменты | Типы желтух | ||
| гемолитическая | печеночно-клеточная | обтурационная | |
| Непрямой билирубин | ↑ | ↑ | Норма, нарастает |
| Прямой билирубин | Норма, нарастает | ↑ | ↑ |
| Мезобилиноген | - | + | - |
| Уробилин мочи | ↑ | ↓ | - |
| Стеркобилин кала | ↑ | ↓ | - |
| Билирубин мочи | - | + | - |
143. Обмен железа: всасывание, транспорт кровью, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз.
В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина. Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. Железо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин.

Транспорт железа в плазме крови и его поступление в клетки. В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%. Трансферрин взаимодействует со специфическими мембранными рецепторами клеток. В результате этого взаимодействия в цитозоле клетки образуется комплекс Са2+-кальмодулин-ПКС, который фосфорилирует рецептор трансферри-на и вызывает образование эндосомы. АТФ-зависимый протонный насос, находящийся в мембране эндосомы, создаёт кислую среду внутри эндосомы. В кислой среде эндосомы железо освобождается из трансферрина. После этого комплекс рецептор - апотрансферрин возвращается на поверхность плазматической мембраны клетки. При нейтральном значении рН внеклеточной жидкости апотрансферрин изменяет свою конформацию, отделяется от рецептора, выходит в плазму крови и становится способным вновь связывать ионы железа и включаться в новый цикл его транспорта в клетку. Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине. Ферритин - олигомерный белок с молекулярной массой 500 кД. Он состоит из тяжёлых (21 кД) и лёгких (19 кД) полипептидных цепей, составляющих 24 протомера. Разный набор прогомеров в олигомере ферритина определяет образование нескольких изоформ этого белка в разных тканях. Ферритин представляет собой полую сферу, внутри которой может содержаться цо 4500 ионов трёхвалентного железа, но обычно содержится менее 3000. Тяжёлые цепи ферритина окисляют Fe2+ в Fe3+, Железо в виде гидроксидфосфата находится в центре сферы, оболочка которой образована белковой частью молекулы. Оно поступает внутрь и освобождается наружу через каналы, пронизывающие белковую оболочку апоферритина, но железо может откладываться и в белковой части молекулы ферритина. Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритина экскретируется из тканей з плазму крови. Поскольку поступление ферритина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови - важный диагностический показатель запасов железа в организме при железодефидитной анемии.
Нарушения метаболизма железа. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках.
Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу. Гемохроматоз может быть обусловлен наследственным увеличением всасывания железа в кишечнике, при этом содержание железа в организме больных может достигать 100 г. Это заболевание наследуется по аутосомнорецессивному типу, причём около 0,5% европеоидов гомозиготны по гену гемохроматоза. Накопленш гемосидерина в поджелудочной железе приводит к разрушению р-клеток островков Лангерханса и, как следствие этого, к сахарному диабету. Отложение гемосидерина в гепатоцитах вызывает цирроз печени, а в миокардиоцитах - сердечную недостаточность. Больных наследственным гемохроматозом лечат регулярными кровопусканиями, еженедельно или один раз в месяц в зависимости от тяжести состояния больного. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо.
144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
В плазме крови содержится 7% всех белков организма при концентрации 60 - 80 г/л. Белки плазмы крови выполняют множество функций. Одна из них заключается в поддержании осмотического давления, так как белки связывают воду и удерживают её в кровеносном русле. Белки плазмы образуют важнейшую буферную систему крови и поддерживают рН крови в пределах 7,37 - 7,43. Альбумин, транстиретин, транскортин, трансферрин и некоторые другие белки выполняют транспортную функцию. Белки плазмы определяют вязкость крови и, следовательно, играют важную роль в гемодинамике кровеносной системы. Белки плазмы крови являются резервом аминокислот для организма. Иммуноглобулины, белки свёртывающей системы крови, α1-антитрипсин и белки системы комплемента осуществляют защитную функцию. Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови можно разделить на альбумины (55-65%), α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%). Применение других сред для электрофоретического разделения белков позволяет обнаружить большее количество фракций. Например, при электрофорезе в полиакриламидном или крахмальном гелях в плазме крови выделяют 16-17 белковых фракций. Метод иммуноэлектрофореза, сочетающий электрофоретический и иммунологический способы анализа, позволяет разделить белки плазмы крови более чем на 30 фракций. Большинство сывороточных белков синтезируется в печени, однако некоторые образуются и в других тканях. Например, γ-глобулины синтезируются В-лимфоцитами, пептидные гормоны в основном секретируют клетки эндокринных желёз, а пептидный гормон эритропоэтин - клетки почки. Для многих белков плазмы, например альбумина, α1-антитрипсина, гаптоглобина, транс-феррина, церулоплазмина, α2-макроглобулина и иммуноглобулинов, характерен полиморфизм.
Не нашли, что искали? Воспользуйтесь поиском: