
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Термодинамическая номенклатура водных систем. Активность и коэффициент активности.
Акти́вность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Активность отличается от общей концентрации на некоторую величину. Отношение активности (~a) к общей концентрации вещества в растворе называется коэффициентом активности:
 Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др
33. Основы электростатической теории сильных электролитов. Средняя плотность зарядов (φ) ионной атмосферы.
В 1923 г. Дебай и Гюккель создали теорию сильных электролитов.
Согласно этой теории в растворах сильных электролитов действуют электростатические силы притяжения между разноименными ионами и силы отталкивания — между одноименными. Вокруг каждого иона образуется ионная атмосфера, состоящая из ионов противоположного знака. Каждый из ионов этой атмосферы находится в окружении другой ионной атмосферы. Поэтому раствор сильного электролита можно рассматривать как систему равномерно распределенных по всему объему сосуда разноименных ионов, каждый из которых находится в центре силового поля, создаваемого окружающими ионами
Тепловое движение постоянно изменяет картину распределения ионов в такой сфере: в ней происходит постоянный ионный обмен. Ввиду того, что радиус ионной атмосферы относительно велик, атмосферы двух соседних ионов пересекаются, в результате чего каждый ион в данный момент может входить в состав одной или даже нескольких ионных атмосфер других ионов.
Все это обусловливает довольно сложные взаимоотношения между компонентами раствора, которые не могут не сказать.
Энергия, связанная с ионной атмосферой, имеет электрическое происхождение, поэтому она должна быть функцией плотности электрического заряда и потенциала, создаваемого ионной атмосферой. Тепловое движение ионов в ионной атмосфере приводит к тому, что дискретные заряды этих ионов как бы размазываются. В результате ионную атмосферу, состоящую из отдельных ионов, в среднем за некоторый промежуток времени можно моделировать облаком размазанного заряда, плотность которого r уменьшается по мере удаления от центрального иона. Для связи между средней плотностью заряда r и отвечающим ему средним значением потенциала y можно использовать уравнение Пуассона
Ñ2y = – 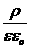 ,
,
где Ñ2 – оператор Лапласа Ñ2 =  +
+  +
+  .
.
34. Зависимость электрического потенциала ψ и плотности φ от расстояния r до центрального иона
Поскольку ионная атмосфера обладает шаровой симметрией, то уравнение Пуассона, записанное в сферической системе координат, принимает вид
 +
+  = –
= – 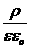
и связывает объемную плотность заряда r с потенциалом y на расстоянии r от центрального иона. В уравнение Пуассона входят две неизвестные величины: r и y. Для их определения необходимо иметь второе уравнение, связывающее обе эти переменные. Дебай и Гюккель получили нужное уравнение следующим образом.
Для раствора в целом и для любого заданного его объема, достаточно большого по сравнению с размерами иона, справедливо условие электронейтральности
å niezi = 0,
где ni – число ионов i- го сорта в единице объема (если выбран объем раствора, равный единице). Однако заряд некоторого элемента объема dV, находящегося вблизи какого-либо иона, будет отличаться от нуля вследствие существования ионной атмосферы. Если центральный ион, расположенный в начале координат, заряжен положительно, то элемент объема dV будет обладать избыточным отрицательным зарядом. Предполагая, что к распределению ионов в растворе применим принцип Больцмана и что силы, действующие между ионами, по своей природе электростатические, число отрицательных и число положительных ионов в элементарном объеме dV можно выразить как
35. Потенциал и радиус ионной сферы. Предельный закон Дебая – Хюккеля. Дальнейшее развитие теории.
Величина y в последнем уравнении представляет собой среднее значение потенциала в точке r, создаваемое ионной атмосферой и центральным ионом. Для вычисления ион-ионного взаимодействия представляет интерес не общий потенциал y, а та его часть y а, которая создается ионной атмосферой в месте расположения центрального иона. y а называется потенциалом ионной атмосферы. Его находят по правилу суперпозиции (то есть наложения) потенциалов:
y а = y – y i =  (exp (–c r) – 1).
(exp (–c r) – 1).
Для вычисления энергии взаимодействия необходимо определить потенциал ионной атмосферы в точке нахождения центрального иона, то есть найти предел y а при r ® 0. Это можно сделать, используя тот же прием (разлагая показательную функцию в ряд и пренебрегая высшими членами разложения):
lim y а = y¢ = –  c.
c.
Величину y¢ можно рассматривать как потенциал, создаваемый в точке нахождения центрального иона другим ионом с противоположным знаком, находящимся от центрального иона на расстоянии 1/c. Величина 1/c называется характеристической длиной. Так как потенциал создается не единичным ионом, а всей ионной атмосферой, то 1/c можно отождествить с радиусом ионной атмосферы. Величину c можно рассчитать по вышеприведенному уравнению.
Не нашли, что искали? Воспользуйтесь поиском: