
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Переработка молибденитовых концентратов /окислительный обжиг, азотнокислотное разложение/.
Технологическая схема:
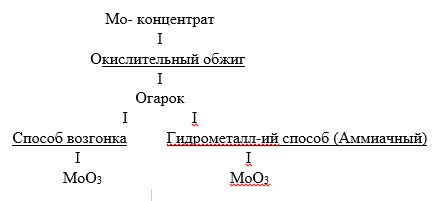
а) Окислительный обжиг молибденитовых концентратов. При t 500oC происходит окисление молибденита с образованием триоксида молибдена:
MoS2+3,5O2=MoO3+2SO2;
MoS2+ MoO3=MoO3+SO2, когда большая часть молебденита прореагирует, образуя ангидрид, будет окисляться до высшего оксида: MoO2+1/2O2=MoO3.
Присутствие в концентрате сульфидов: Cu, Fe, Zn, Pb при t 550-600oC будут реагировать с кислородом с образованием оксидов и сульфатов: MeS+1,5O2=MeO+SO2; SO2+O2=2SO3;
SO3+MeO= MeSO4, а именно:
Железо: FeSO4 = FeO+ SO3 (450-500оC);
Медь: CuSO4 = CuO + SO3 (600-650оC);
Цинк: ZnSO4=ZnO+SO3 (700оC)
Кальцит: CaСO3=CaO+СO2.
Взаимодействие между триоксидами Mo и оксидами, карбонатами, сульфатами элементов-примесей с образованием молибдатов: (при 500-6000С таких как: CuMoО4, Fe2(MoО4)3, ZnMoO4, CaMoО4), а кремнезем который присутствует в концентрате не взаимодействует с оксидом молибдена.
Обжиг проводится в печах кипящего слоя (560-6000С избегая плавления MoO3 который имеет при tпл.750оС). Так как реакции протекают со значительным выделением тепла осуществляют отвод избыточного тепла с помощью водохлаждаемых змеевиков.
Пылевынос из печи 20-40%, необходимость в установлении системы пылеулавливания, состоящая из циклонов и электрофильтров. Пыль из циклонов содержит 8-10% S, которая возвращается в операцию обжига.
С газами удаляется более 90% Re, в виде оксида (Re2O7).
Полученный огарок практически не содержит сульфида Mo это обеспечивает высокое извлечение Mo в аммиачные растворы в процессе выщелачивания огарка.
b) Отчистка молибденового ангидрида. Известны два основных способов получения чистого молибденового ангидрида: способ возгонки и гидрометаллургический способ.
Гидрометаллургический способ (аммиачный). Технологическая схема:

Основная реакция выщелачивания:
MoO3+2NH4OH=(NH4)2MoO4+H2O.
Степень извлечения Мо зависит от состава огарка. Сульфаты и молибдаты (Cu, Ni, Fe, Zn) обр-ют водораств-ые аммонийные соли:
MeSO4+4NH4=[Me(NH4)4SO4]+4H2O;
MeMoO4+4NH4OH=Me(NH4)4MoO4+4H2O.
Огарки выщелачивают 8-10% раствором аммиака, расход которого 120-140% от стехиометрически необходимого количества, в стальных реакторах на холоде или при нагревании 50-60оС при отношении Т:Ж=1:4.
В результате процесса в конечном растворе избыточная концентрация аммиака должна быть порядка 25-30 г/л для предотвращения образования малорастворимых молибдатов. Извлечение Мо в раствор 80-95%. Зависит от состава огарков. Выход хвостов 10-25% (10% Мо), которые направляются на переработку (щелочным или содовым методами).
Получение порошка молибдена. Порошок Mo можно получить восстановлением его высших оксидов водородом. Восстановление молибденового ангидрида водородом протекает в две стадии:
МоO3+H2=МоO2+H2O (1); МоO2+2H2=Мо+2H2O (2).
Восстановление МоO 3 проводят в трубчатых вращающихся печах с механизированной загрузкой и выгрузкой.
Первую стадию восстановление трёхоксида молибдена проводят при t 450-650°С. Образование МоO2 должно заканчиваться при t 550°С, так как промежуточные оксиды образуют с МоO3 легкоплавкие эвтектики при t 550-600°С.
Вторая стадия восстановления проводится при t 650-950°С. В качестве восстановителя используется хорошо высушенный водород. После второго восстановления порошок молибдена содержит порядка 0,5-1,5% кислорода.
Для снижения сод-ия кислорода в молибденовом порошке иногда проводят третью стадию восстановления при t 1000-1100°С. Третья стадия восстановления осуществляется в трубчатых печах с герметизированным кожухом, заполненным водородом, для защиты труб и нагревателей от окисления.
Порошки восстановления содержат 0,25-0,3% кислорода.
Рений, физические и химические свойства, важнейшие соединения, сырьевые источники. Поведение рения в производстве молибдена и меди. Извлечение рения из растворов /сорбция и экстракция/. Получение порошка рения.
Ф из-хим. свойства. Re- светло-серый металл, один из самых тяжелых и тугоплавких, плотность 21,01 г/см3, tпл 3180°С. Химически очень стоек. При температурах выше 300°C рений сгорает в атмосфере, содержащей кислород, причем образуется как высший оксид Re2O7, так и оксид ReO3. Во влажном воздухе рений медленно окисляется до HReO4. С галогенами при нагревании рений реагирует. Рений — это единственный элемент, который образует устойчивый гептафторид ReF7. С иодом рений не взаимодействует. Реагирует только с азотной и горячей серной кислотами и раствором перекиси водорода. С растворами щелочей рений взаимодействует медленно.
Важнейшие соединения рения: Диоксид рения, ReO2, нелетучий коричнево-черный кристаллический порошок с металлическим типом проводимости, устойчивый на воздухе при комнатной температуре. Дисульфид рения, ReS2, черные мягкие кристаллы. Триоксид рения, ReO3, кристаллы темно-красного цвета с металлическим блеском. Оксид рения(VII), Re2O7, рениевый ангидрид, светло-желтые, сильно гигроскопичные кристаллы. Перренат аммония, NH4ReO4, бесцветные кристаллы, растворимые в воде.
Сырьевые источники. Самостоятельных минералов он не образует. В природе содержится как небольшая примесь в минералах, содержащих молибден, медь, цирконий, ниобий или платину. Содержание рения в этих рудах очень мало, в молибдените MoS2, где рений изоморфно замещает молибден, его содержание составляет 0,6-20 г/т.
Не нашли, что искали? Воспользуйтесь поиском: