
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Определение реакции и особенности ее протекания
Восстановление производных бензола, нафталина и гетероциклических соединений по Берчу
Курсовая работа
по органической химии
студента 3 курса 2 группы
Кудако А. А.
Минск 2014 г.
Содержание
Введение..............................................................................................................................................................3
1. Реакция Берча...............................................................................................................................................5
1.1. Определение реакции и особенности ее протекания.........................................................................5
1.2. Механизм реакции................................................................................................................................6
1.3. Кинетика реакции.................................................................................................................................8
1.4. Конденсированные ароматические соединения в реакции Берча..................................................10
1.5. Гетероциклические соединения в реакции Берча............................................................................12
1.6. Побочные реакции..............................................................................................................................13
1.7. Модификации реакции Берча............................................................................................................16
2. Синтетическая полезность реакции Берча..............................................................................................18
Заключение.......................................................................................................................................................21
Литература........................................................................................................................................................22
Введение
Органическая химия – одна из тех химических наук, которая обладает огромным набором разнообразных органических веществ, число которых значительно превышает количество неорганических соединений. Этому способствовало не только изомерия (в том числе и стерео-), но и также «большая библиотека» химических реакций, благодаря которым можно получить новые вещества, и наука на этом не остановилась: на сегодняшний день учеными и специалистами разрабатываются новые модификации известных уже реакций, подбираются новые реагенты, катализаторы, растворители, осуществляется поиск оптимальных условий для протекания процесса. Все это может способствовать селективному и специфичному протеканию реакции, что очень важно в органическом синтезе.
Помимо типичных реакций, для органической химии характерно огромное число именных реакций, которые были открыты когда-то органиками-исследователями, что позволило в дальнейшем применять их для получения не только веществ промышленного значения, но и также биологически активных соединений, что значительно сократило использование природного сырья, которого в последние годы все меньше и меньше.
В данной работе рассмотрена одна из основных и полезных в синтетическом плане реакций, открытая Артуром Берчем в середине ХХ века.
 Артур Берч (Arthur John Birch) (1915 — 1995) — австралийский ученый-химик, действительный член Австралийской академии наук (1954, в 1982-1986 президент), иностранный член Академии наук СССР (1976; РАН с 1991). Окончил Сиднейский университет, где получил степень бакалавра (1937), а затем — магистра (1938). В Оксфордском университете под руководством Р. Робинсона он защитил докторскую диссертацию (1940) и работал вместе с ним до 1948 года. В 1949 году Берч получил от Английского Королевского общества стипендию Смитсона и переехал в Кембриджский университет, где работал до 1952 года. В 1952-1957 гг. Берч — профессор органической химии Сиднейского университета, одновременно с 1954 — Манчестерского университета. В 1958 году он становится членом Английского Королевского общества. В 1967 году ученый вернулся в Австралию и основал Научно-исследовательскую химическую школу при Австралийском национальном университете в Канберре, оставаясь ее деканом до 1980 года. Одновременно (1977-1978) Берч занимал пост президента Королевского Австралийского химического института, а также был членом комиссии при Организации Содружества по научно-промышленным исследованиям. Кроме того, Берч был одним из основателей Австралийского совета по науке и технологии.
Артур Берч (Arthur John Birch) (1915 — 1995) — австралийский ученый-химик, действительный член Австралийской академии наук (1954, в 1982-1986 президент), иностранный член Академии наук СССР (1976; РАН с 1991). Окончил Сиднейский университет, где получил степень бакалавра (1937), а затем — магистра (1938). В Оксфордском университете под руководством Р. Робинсона он защитил докторскую диссертацию (1940) и работал вместе с ним до 1948 года. В 1949 году Берч получил от Английского Королевского общества стипендию Смитсона и переехал в Кембриджский университет, где работал до 1952 года. В 1952-1957 гг. Берч — профессор органической химии Сиднейского университета, одновременно с 1954 — Манчестерского университета. В 1958 году он становится членом Английского Королевского общества. В 1967 году ученый вернулся в Австралию и основал Научно-исследовательскую химическую школу при Австралийском национальном университете в Канберре, оставаясь ее деканом до 1980 года. Одновременно (1977-1978) Берч занимал пост президента Королевского Австралийского химического института, а также был членом комиссии при Организации Содружества по научно-промышленным исследованиям. Кроме того, Берч был одним из основателей Австралийского совета по науке и технологии.
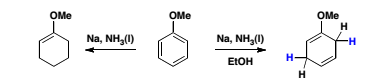
Имя А. Берча носит реакция восстановления ароматических соединений в жидком аммиаке при действии щелочного металла и спирта с образованием на первой стадии циклогексадиенов - 1,4. Значение этой реакции, впервые открытой американским химиком К. Вустером (1939), а позднее (1944) исследованной и развитой Берчем, заключается в широте ее применения и простоте эксперимента, а также в том, что получаемые соединения очень сложно синтезировать другими методами. Восстановлению по Берчу были подвергнуты органические соединения различных классов, включая метоксипроизводные бензольного ряда, бензойные и нафтойные кислоты, нафтолы, гетероциклические соединения. В 1948 году Берч провел свой первый синтез мужского полового гормона (19-нортестостерона), ставший первым в новой серии этих соединений, благодаря чему появились первые противозачаточные таблетки. На основе реакции восстановления по Берчу были получены аналоги стероидов, антибиотики и другие медикаменты. А. Берч является автором около 450 научных трудов.
Реакция Берча
Определение реакции и особенности ее протекания

Реакция Берча – восстановление бензольного кольца ароматических соединений и их производных, требующая использования в качестве восстановителя щелочной металл, в основном натрий или литий, растворенный в жидком аммиаке в полярной среде, являющейся источником протонов, например спирты, для уменьшения числа ароматических двойных связей до двух несопряженных двойных связей (общее название такой реакции – восстановление растворенным металлом):
Первоначально эту реакцию проводили, прибавляя металлический натрий к реакционной смеси, состоящей из восстанавливаемого соединения, жидкого аммиака и абсолютного спирта. Позже было найдено, что выходы диеновых продуктов увеличиваются при замене натрия на литий. При использовании лития восстановление осуществляется даже в тех случаях, когда натрий не эффективен. В этом методе спирт добавляют в конце реакции. Для повышения растворимости исходного вещества в реакционную смесь часто добавляют эфир, тетрагидрофуран или 1,2-диметоксиэтан.
Как известно, ароматические соединения не являются реакционноспособными из-за особой устойчивости ароматического кольца, это позволяет использовать восстановление по Берчу для превращения неактивных π-связей ароматической системы в активные изолированные двойные связи.
С чем связан выбор в качестве восстановителей именно щелочных металлов? Металлический натрий является мощным одноэлектронным восстановителем, и в растворе аммиака с ним образуется катион и сольватированный электрон (раствор приобретает синюю окраску), что можно использовать для восстановления большого числа функциональных групп. Такая система используется не только в промышленной химии, но и также в фармацевтической. Несмотря на эти преимущества, существует ряд недостатков, которые ограничивают применение реакции. Это токсичность жидкого аммиака (сам аммиак – бесцветный газ, раздражающий кожу, дыхательные пути, глаза), криогенные температуры (температура кипения аммиака -33 °С) и обработка щелочных металлов. К тому же коммерчески доступный аммиак часто загрязнен солями железа, что снижает выход восстановления по Берчу, поэтому предварительно необходимо перегнать аммиак. Таким образом, при использовании аммиака в качестве растворителя необходимо использовать низкие температуры, при необходимости их повышения нужно контролировать давление в реакционном сосуде, чтобы не произошло спонтанного (со взрывом колбы!) высвобождения газообразного аммиака (наличие вентиляции тоже обязательно!). Натрий, в свою очередь, бурно реагирует с водой, при этом выделяется водород, который чрезвычайно воспламеним. Большое количество теплоты, выделяющееся при этой реакции, расплавляет и сам натрий, что в итоге может привести к «фейерверку». Попадание натрия в глаза тоже опасно: при контакте с жидкостью образуется гидроксид, разрушительный для живой ткани.
Механизм реакции

Рассмотрим протекание процесса на примере бензола.

Натрий передает электрон ароматическому кольцу, окисляясь при этом до Na+, что приводит к образованию анион-радикала.
Анион-радикал отщепляет от спирта протон с образованием радикала, который под действием натрия превращается в карбанион. И наконец анион присоединяет еще один протон. Таким образом, спирт служит источником протонов, т.к. для многих субстратов кислотность аммиака является недостаточной. В отсутствие спирта часто образуется продукт димеризации анион-радикала.
Возникает вопрос: почему карбанион присоединяет протон к положению 6, давая 1,4-диен, а не к положению 2, что бы могло дать 1,3-диен. Считается, что в данном случае выполняется принцип наименьшего движения, согласно которому легче протекают те элементарные реакции, в которых происходят наименьшие изменения взаимного расположения атомов и электронной конфигурации атомов.
К рассматриваемому случаю его можно применить следующим образом: порядок шести С-С связей (в предположении, что каждая из трех форм вносит равный вклад) следующий (при движении по кольцу):  , 1, 1,
, 1, 1,  ,
,  и
и  . При превращении карбаниона в диен порядок связи меняется следующим образом:
. При превращении карбаниона в диен порядок связи меняется следующим образом:

При образовании 1,4-диена изменение описывается суммой  , тогда как при образовании 1,3-диена
, тогда как при образовании 1,3-диена  . Видно, что получение 1,3-диена сопровождается изменением порядка связей, поэтому образуется, согласно принципу наименьшего движения, 1,4-диен.
. Видно, что получение 1,3-диена сопровождается изменением порядка связей, поэтому образуется, согласно принципу наименьшего движения, 1,4-диен.

Влияние заместителей в бензольном кольце согласуется с приведенным выше механизмом. Скорость восстановления возрастает при наличии электроноакцепторных заместителей, что объясняют промежуточным образованием анион-радикала, в котором отрицательный заряд располагается как можно ближе к электроноакцепторной группе, и протонирование при этом происходит в положения 1 и 4 бензольного кольца; восстановление аренов с электронодонорными заместителями протекает медленнее, т.к. они затрудняют протекание первой, медленной стадии реакции − передачу электрона от щелочного металла к молекуле ароматического соединения, и протонирование осуществляется в положения 2 и 5:

Например,

Определенное влияние оказывают также стерические эффекты: объемные заместители замедляют реакцию, поскольку они ухудшают сольватацию образующегося аниона. В то же время нужно отметить, что большинство акцепторных групп в условиях реакции Берча восстанавливаются сами, причем обычно в первую очередь (см. «Побочные реакции»). Поэтому львиная доля примеров восстановления по Берчу ароматических производных, содержащих электроноакцепторные группы, связана с использованием ароматических кислот или их амидов. При этом последние восстанавливаются в ароматические альдегиды, если в качестве источника протона применять не спирт, а ацетат аммония.
Восстановление сложных эфиров обычно протекает по карбонильной группе, хотя иногда они все же образуют продукты восстановления по Берчу, причем основным продуктом обычно является не диен, а соответствующий циклогексен.

В реакциях с +М-замещёнными ароматическими циклами образуется побочный продукт — сопряжённый 1,3-циклогексадиен. На концентрацию сопряжённого диена в выходе влияет сила мезомерного эффекта заместителя. Например,

Как видно из механизма, важную роль играет растворитель:
 Иногда сам аммиак может выступать и в качестве растворителя и быть источником протонов (с образованием амид-иона):
Иногда сам аммиак может выступать и в качестве растворителя и быть источником протонов (с образованием амид-иона):
Кинетика реакции
Стехиометрическое уравнение протекания восстановления по Берчу бензола имеет вид:
2Li + 2CH3OH + C6H6 → 2LiOCH3 + C6H8
Реакция отличается от обычного полного гидрирования:
3H2 + C6H6 → C6H12
Несмотря на важность реакции, существует ряд трудностей с кинетическим уравнением реакции. Одни считают, что реакция имеет третий порядок:
 ,
,
где В – ароматическое соединение; ВН2 – продукт восстановления; М – растворенный щелочной металл; А – спирт.
Другие ставят под сомнение данный механизм, т.к. возможно протекание параллельного процесса
2Li + 2CH3OH → 2LiOCH3 + H2
и суммарная реакция описывается уравнением для скорости 4-го порядка:

При этом выход увеличивается в ряду щелочных металлов K–Na–Li, реакция протекает быстрее с этанолом, чем бутанолом и ускоряется добавлением бромидов с катионами, общими с раствором щелочного металла, и процесс имеет очень малую энергию активации.
В то же время известно, что переходная система содержит не нейтральный металл в качестве основного компонента, а катион М+ и е–, полученный при ионизации металла. Этот электрон образует с ароматическим соединением анион-радикал В–, который образует ионную пару с катионом (М+ В–). Последний, в свою очередь, реагирует со спиртом. Поэтому суммарное кинетическое уравнение

Это совпадает с предыдущей формулой в случае разбавленных растворов. Но тем не менее эта формула хорошо описывает кинетику процесса.
Существует некоторое противоречие насчет участия спирта в процессе. Согласно описанным выше уравнениям скорость пропорциональна концентрации спирта. С другой стороны, утверждается, что реакция замедляется добавлением алканоатов щелочных металлов, что связывают с образованием иона аммония в результате равновесия
ROH + NH3 ↔ RO– + 
Он и тормозит протекание процесса.
Скорость протекания восстановления по Берчу зависит от относительных скоростей двух стадий, описанных выше, и эта зависимость значительна по сравнению с обычным гидрированием бензола.


Как видно из графика 1 скорость определяется природой щелочного металла. Наибольшая скорость наблюдается при использовании лития, наименьшая – в случае калия, и в ряду Li–Na–K начальные скорости соотносятся как 13:1,2:1, в то время как при проведении прямого гидрирования наблюдается прямо противоположная картина (график 2).
| Рис. 1. Изменение концентрации бензола от времени с использованием различных щелочных металлов (восстановление по Берчу) |
| Рис. 2. Изменение скорости гидрирования бензола от концентрации различных щелочных металлов |
Также скорость процесса сильно зависит от природы спирта. В ряду метанол–этанол–пропанол-2 относительные скорости с натрием или литием приблизительно соотносятся как 1:0,55:0,15. Добавление солей лития (LiBr, LiOCH3) в реакционную смесь дает умеренное, но определенное увеличение скорости.
Не нашли, что искали? Воспользуйтесь поиском: