
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Дать определение удельной и молярной теплоемкости газа. Описать уравнение Майера.
Теплоёмкостью тела С называется физическая величина, определяемая в виде отношения
сообщённого телу количества теплоты δQ к вызванному изменению температуры dT:
 (*).
(*).
Молярной теплоёмкостью называется теплоёмкость одного моля вещества, которая определяет на сколько градусов, например по Кельвину, нагреется один моль вещества при сообщении ему количества теплоты δQ=1 Дж

Удельная теплоёмкость характеризует процесс нагревания или охлаждения единицы массы вещества: 
Рассмотрим процесс нагревания идеального газа. Запишем уравнение первого начала термодинамики с учётом уравнения (*), из которого выразим количество тепла
 (**).
(**).
При постоянстве объёма V=const, dV=0, поэтому  (***),
(***),
где СV − теплоемкость газа при постоянном объёме.
Предположим, что для идеального газа теплоёмкость не является функцией температуры, Проинтегрируем уравнение (***): 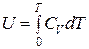 .
.
Проинтегрируем далее уравнение (**) при условии постоянства давления p=const:
 .
.
Для реальных газов, молекулы которых расположены друг к другу ближе, чем у идеальных газов, теплоёмкость определяется не только абсолютной температурой, но и объёмом, поэтому 
Для идеального газа  , т.е.
, т.е.  .
.
При постоянном давлении  имеем:
имеем: 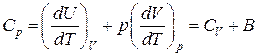 .
.
Для идеального газа справедливо уравнение Клапейрона: pdV=BT, которое можно переписать в виде уравнения Майера: 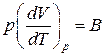 .
.
Из полученных уравнений очевидно, что теплоёмкость газа при постоянном давлении больше, чем при постоянном объёме. Дело в том, что при постоянстве давления должен изменяться объём газа, что сопровождается работой против внешних сил, отсюда и неравенство Cp>CV.
Для одного моля идеального газа уравнение состояния, как известно, записывается в виде  , где Vμ − объём одного моля газа,
, где Vμ − объём одного моля газа,
R − универсальная газовая постоянная.
Значит, 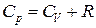 .
.
Отношение теплоёмкостей  является индивидуальным для каждого газа и зависит от кинетической энергии отдельных молекул.
является индивидуальным для каждого газа и зависит от кинетической энергии отдельных молекул.
Величину γ называют коэффициентом Пуассона.
Задача 7
Кислород массой 2 кг занимает объем 1 м3 и находится под давлением 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема 3 м3, а затем при постоянном объеме до давления 0,5 МПа. Найти изменение внутренней энергии газа, совершенную им работу и теплоту, преданную газу. Построить график процесса.
Дано:


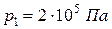


|
 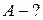
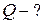
|
Решение.

Рассмотрим участок 1-2 – изобарный процесс.
Работа в данном случае равна:  .
.
Изменение внутренней энергии равно:  ,
,
где  - молярная масса кислорода,
- молярная масса кислорода,
 - число степеней свободы кислорода (двухатомный газ).
- число степеней свободы кислорода (двухатомный газ).
По уравнению Менделеева-Клапейрона для состояний 1 и 2 имее:
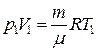 ,
, 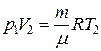 .
.
Значит, 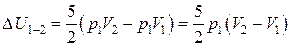 .
.
Рассмотрим участок 2-3 – изохорный процесс.
При постоянном объеме работа газа равна нулю:  .
.
Изменение внутренней энергии равно: 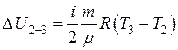 .
.
По уравнению Менделеева-Клапейрона для состояний 2 и 3 имеем:
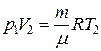 ,
,  .
.
Значит,  .
.
Суммарная работа цикла равна:  .
.
Значит,  .
.
Суммарное изменение внутренней энергии равно:  .
.
Значит,  .
.
По первому началу термодинамики имеем:  .
.
Значит,  .
.
Получаем,  ,
,
 ,
,
 .
.
Ответ.  ,
, 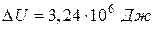 ,
,  .
.
Ответить на теоретические вопросы:
Не нашли, что искали? Воспользуйтесь поиском: