
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Сутектік байланыс.Оның түзілу механизмі
Сутектік байланыс құрамына сутегі мен электртерістігі күшті элемент-O,N,S,F,кіретін молекулалар арасында пайда болады.Сутектік байланыс әртүрлі молекулалар арасында ж\е бір молекула ішіндегі әртүрлі топтар арасында пайда болады.Сутек атомының ішкі электрондық қауызы болмағандықтан,теріс полюстенген атомның электрондық қауызының ішіне еніп кете алады.Сутектік байланыс суда ғана емес,полимерлерде,белокта,сан алуан кристалдық заттарда түзіледі.
18.Тотығу-тотықсыздану реакциялары деп электрондардың бір бөлшектерден екіншіге ауысуымен байланысты жүретін реакцияларды айтады,яғни әрекеттесуші молекулалар құрамына енетін элемент атомдарының тотығу дәрежесінің өзгеру.Тотығу процесі– атомның электрондарды беріп тотығу дәрежесінің өсуі.Тотықсыздану процесі-атомның электронды қосып алып тотығу дәрежесінің кемуі.Тотығу-тотықсыздану реакциялары 4 бөлінеді :1)молекула ішілік -тотықтырғышпен тотықсыздандырғыштың ролін иондағы элемент атомдары атқарады.Бұл реакция температуралық қыздырумен альфа бөлшекпен атқылау кезінде жүреді. 2)молекулааралық -жайж\е күрделі заттармен иондардың қатысуымен жүреді.Бір заттағы екі элемент атомы бірден тотығуға да тотықсыздануғада қатыса алады .3)дисмутация -элемент атомдарының тотығу дәрежесінің бірден жоғарылауымен төмендеуңі арқылы жүреді. 4)конпропорциялану -реакцияда атомдардың тотығу дәрежесі теңеседі.Қасиеттеріне қарай элементтері 3 топқа бөлінеді 1) тотықтырғыш а) қосылыстарда ең жоғары тотығу дәрежесін көрсететін элем атомы.
б) F,O атомдары мен молекулалары
2. тотықсыздандырғыштар а)s,p,d,f ұяшықтарының металдың бос атомдары
б) қосылыстарда ең теріс тотықсыздану дәрежесін көрсететін элем атомдары
3. тотықтырғыш та,тотықсыздандырғыш та жатады. а)4-6 топшалардың бейметал молекулалары
б) қосысылғыштар аралығында оң тотығу дәрежесін көрсететін элем атомдары
в) асқын тотық қосылыстар
Электрондық баланс әдісі реакцияға қатысқан және түзілген заттардағы элементтердің
тотығу дәрежелерін салыстыруға негізделген.
Мысалы
3+ 7+ 5+ 2+
KNO2+NaMnO4+H2SO4 KNO3+MnSO4+Na2SO4+H2O
N3+-2e=N5+ 5 тотығу пр зат тот-сыз-ғыш
Mn0+5e=Mn2+ 2 тотықсыздану пр зат тот-р-ғыш
5KNO2+2NaMnO4+H2SO4=5KNO3+2MnSO4+Na2SO4+H2O
Ионды-электрондық әдіс тотықсыздандырғыштың тотығуының,тотықтырғыштың тотықсыздануының иондық теңдеулерін жеке-жеке құрып,содан соң оларды жаолпы иондық теңдеуге біріктіруге негізделген.
Мысылы Na2CO3+HOH ↔ NaHCO3+NaOH
2Na++CO32-+HOH Na++HCO3-+Na++OH-
CO32-+HOH HCO3-+OH-
22.Ерітінділер, анықтамасы, жіктелуі. Ерітінділердің концентрациялары туралы түсінік,оларды өрнектеу жолдары. Ерітінділер деп еріген зат пен ерікіштен және олардың әрекеттесу өнімдерінен тұратын гомогенді физикалық-химиялық жүйелерді айтады.Ерітіндіні құрайтын заттар компоненттер деп аталады.Еріген зат – ерітіндіде аз мөлшерде болатын зат.Агрегаттық күйі бойынша ерітінділер сұйық,қатты және газ ерітінділеріне бөлінеді.Еріткіштің табиғатына қарай сұйық ерітінділерді сулы және сулы еместерге жіктеуге болады.Еріткіштік –заттың еріткіште еруге қабілеттілігі.Ерітіндінің концентрациясы – ол көлем н/е масса бірлігіне зат н/е масса санының қатынасын көрсететін шама.Ерітінділердің концентрацияларының 5түрі болады:
a) еріген заттың массалық үлесі (пайыздық концентрация) ─ еріген зат массасының ерітіндінің жалпы массасына қатынасы:ω═mз\m
b) молярлы концентрация ─ 1 л ерітіндідегі еріген заттың моль саны,С=n/V[моль/л]
c) эквиваленттік молярлы концентрация (нормальдік) ─ еріген зат мөлшері эквивалентінің ерітінді көлеміне қатынасы,C=n/V [моль/л]
d) моляльді концентрация ─ еріген зат мөлшерінің еріткіш массасына қатынасы,b(x)=n/m [моль/кг]
e) ерітіндінің титрі ─ грамдап алынған зат массасының ерітіндінің 1 миллилимріне қатынасы,T=m/V [г/мл].
23Химиялық реакциялардың жылдамдығы.Реакция жылдамдығына температураның әсері. Химиялық реакциялардың жылдамдығы V бірлік көлеміндегі реакциялық кеңістіктің бірлігінде бірлік өлшем уақытындағы әрекеттесуші заттар концентрацияларының өзгеруі.Реакциялардың орташа және лездік жылдамдықтарын ажыратады.Орташа жылдамдық тең v = (C1-C2) / (t1-t2) = -ΔC /Δt. Берілген уақынтағы реакция жылдамдығы лездік жылдамдығы дейді,ол тең V = ±dC/dt
Реакция жылдамдығының температурадан тәуелділігі Вант–Гофф ережесімен анықталынады: температураны әрбір 10º көтергенде көптеген реакциялардың жылдамдығы 2 –4 есе артады. Бұл тәуелділікті математикалық тұрғыдан алғанда келесідей қатынаспен өрнектейді v(t2)=v(t1)*γ(t2-t1)/10γ- реакция жылдамдығының температуралық коэффициенті,ол температураны он градусқа көтергендегі реакция жылдамдығының қанша есе артатындығын көрсетеді.Әрекеттесуші заттар молекуласын белсенді ету үшін оларға берілетін энергияны ─ белсенділеу энергиясы E a деп атайды да кДж/мольмен өрнектейді.Бұл әуелгі берілген заттар молекуласындағы байланыстарды үзу немесе әлсірету үшін керек.
24.Вант – Гофф ережесі. Реакция жылдамдығының температурадан тәуелділігі Вант-Гофф ережесімен анықталынады:температураны әрбір 10º көтергенде көптеген реакциялардың жылдамдығы 2 –4 есе артады.Бұл тәуелділікті математикалық тұрғыдан алғанда келесідей қатынаспен өрнектейдіv(t2)=v(t1)*γ(t2-t1)/10γ-реакция жылдамдығының температуралық коэффициенті,ол температураны он градусқа көтергендегі реакция жылдамдығының қанша есе артатындығын көрсетеді.
25.Аррениус теңдеуі. Реакция жылдамдығы тұрақтысының белсенділеу энергиясы мен температурадан тәуелділігі Аррениус теңдеуімен өрнектеледі:
Ea/RT
k=A·e мұндағы А ─ пропорционалдылық коэффициенті, е ─ натуралдық логарифмдер негізі.
26.Реакциялардың молекулалығы мен реті.. Берілген реакция жүрген кезде әрбір қарапайым актіге қатысатын молекулалар санын сол реакцияның молекулалығы д.а. Егер қарапайым актқа бір молекула қатысса оны мономолекулалық реакция,2-у бимолекула д.а.
27.Активтендіру энергиясы,оның физикалық мағынасы. Әрекеттесуші заттар молекуласын белсенді ету үшін оларға берілетін энергияны ─ белсенділеу энергиясы Ea деп атайды да кДж/мольмен өрнектейді.Бұл әуелгі берілген заттар молекуласындағы байланыстарды үзу немесе әлсірету үшін керек.Реакция жылдамдығы тұрақтысының белсенділеу энергиясы мен температурадан тәуелділігі Аррениус теңдеуімен өрнектеледі:
-Ea/RT
k=A·e мұндағы А ─ пропорционалдылық коэффициенті, е ─ натуралдық логарифмдер негізі.Берілген реакция жүрген кезде әрбір қарапайым актіге қатысатын молекулалар санын сол реакцияның молекулалығы д.а.Егер қарапайым актқа бір молекула қатысса оны мономолекулалық реакция,2-у бимолекула д.а.
28.Реакция жылдамдығына реагенттер концентрацияларының әсері.Әрекеттесуші массалар заңы.Химиялық реакция жылдамдығының тұрақтысы,оның физикалық мағынасы. Химиялық реакция тездеу үшін,реакциялаушы заттардың молекулалары жиі түйісуі қажет.Түйісуді жиілендіру үшін алдымен реакцияласушы молекуланың санын демек,концентрациясын өсіру керек.Химиялық реакцияның жылдамдығы реакциялаушы заттар концентрацияларының көбейтіндісіне тура пропорционал.Мұны әрекеттесуші массалар заңы деп атайды. V=k·[A] ·[B] k ─ пропорционалдық коэффициенті деп аталады.1867ж Гульдбергпен Вааге әрекеттесуші:Берілген температурадағы хим-қ реакцияның жылдамдығы реакция теңдеуіндегі стехиометриялық коэфицеттерге тең болатын көрсеткіш дәрежесіндегі әрекеттесуші заттар концентрацияларының көбейтіндісіне тура пропорцияналды.Әрекеттесуші заттардың концентрациялары 1моль\л тең болса реакция жылдамдығы жылдамдық тұрақтысына тең болады.
29.катализатор Өзі реакцияға түспейтін және өнім құрамына енбейтін бірақ химиялық реакцияның жылдамдығын өзгер-н затты катализатор деп атайды.Бір қатар кат-рлар реакцияны күшті тездетеді-оң катализ дейді.Басқалары реакцияны баяулатады.Бұл теріс катализ.Теріс катализді жиі ингеберлеу деп ал реакция жылдам-н төмендететін катализаторларды-ингибитор деп атайды.Катализатордың қатынасуымен жүретін химиялық реакцияларды -каталиттік дейді.Катализдің 2 түрі бар:гомогенді ж/е гетерогенді.Гомогенді катализ кезінде әрекеттесуші заттар мен катализатор бір фазалы жүйені түзеді-газды н/се сұйық,катализатормен әрекеттесуші заттардың арасында жанасу беті жоқ..Мысалы: SO2+1/2*O2NO=SO3
Гомогенді катализ үшін химиялық реакция жылдам/ң катализатор концентрацияларына пропорцианалды екендігі айқындалған.Гетерогенді катализ кезінде әрекеттесуші заттар мен катализатор әртүрлі фазадан тұратын жүйені түзеді.Мұндай жағдайда катализатор мен әрекеттесуші заттар арасында беттік жанасу шегі болады.Әдетте, катализатор қатты түрдегі зат,ал әрекеттесуші заттар газдар немесе сұйықтық.SO2(г)+1/2*O2(г) = SO3(г)
Гетерогенді катализ кезіндегі барлық реакциялар катализатордың беттік ауданында жүреді.Сондықтан қатты катализатордың белсенділігі беттік аудан/ң қасиеттеріне тәуелді.Тек бір бағытта жүретін реакцияларды қайтымсыз,тура ж\е кері бағытта жүре алатын реакцияны қайтымды д.а.
30.Химиялық реакциялар қайтымды ж/е қайтымсыз болады.
Қайтымды реакциялар деп тура ж/е кері бағытта жүретін реакцияларды айтады. Мұндай реакция теңдеуін жалпы түрде былай өрнектейді: aA+bB  cC Қайтымды реакцияларда тура ж/е кері реакциялардың жылдамдықтары теңескн күйді химиялық тепе-теңдік дейді. Заттардың конц. Температурасы, қысымы өзгергенкезде химиялық тепе-теңдіктің бағыты ығысады, бұл бағытты Ле-Шателье принципі анықтайдыхим-қ тепе-теңдікте тұрған жүйенің жағдайының біреуін өзгерту,тепе-теңдікті солөзгертуге қарсы әрекет туғызатын реакция бағытына қарай ығыстырады.:а)конц. әсері: бастапқы заттың концен. арттырса теңдік оң жаққа ығысады,реак өнімдерінің концен артса сол жаққа ығысады.б) реакцияға қатсатын заттардың біреуі газ болса, онда тепе-теңдікке қысым әсер етеді, қысым артқанда теңдеудің сол жғындағы молекулалар саны оң жағынан көбірекболса, тепе-теңдік оңға,қысымды азайтса солға ығысады.в)Темп.(эндотермиялық) әсері:темп.жоғарлату теңдікті оң жаққа ығыстырады,темп.азайту- сол жаққа ығыстырады.
cC Қайтымды реакцияларда тура ж/е кері реакциялардың жылдамдықтары теңескн күйді химиялық тепе-теңдік дейді. Заттардың конц. Температурасы, қысымы өзгергенкезде химиялық тепе-теңдіктің бағыты ығысады, бұл бағытты Ле-Шателье принципі анықтайдыхим-қ тепе-теңдікте тұрған жүйенің жағдайының біреуін өзгерту,тепе-теңдікті солөзгертуге қарсы әрекет туғызатын реакция бағытына қарай ығыстырады.:а)конц. әсері: бастапқы заттың концен. арттырса теңдік оң жаққа ығысады,реак өнімдерінің концен артса сол жаққа ығысады.б) реакцияға қатсатын заттардың біреуі газ болса, онда тепе-теңдікке қысым әсер етеді, қысым артқанда теңдеудің сол жғындағы молекулалар саны оң жағынан көбірекболса, тепе-теңдік оңға,қысымды азайтса солға ығысады.в)Темп.(эндотермиялық) әсері:темп.жоғарлату теңдікті оң жаққа ығыстырады,темп.азайту- сол жаққа ығыстырады.
31.Электрохимиялық процестердің анықтамалары мен жіктелуі.Электродтық потенциалдар туралы түсінік. Стандартты электродтық потенциалдар.Металл электродының потенциалын есептейтін Нернст теңдеуі.Химиялық және электрлік түрдегі энергияның өзара бірінің- біріне айналуымен шұғылданатын ғылым саласын электрохимия,ал процестің өзін– электрохимиялық процесс д.а.Электрохимиялық процестердің түрлері: гальваникалық элемент және электролиз.Гальваникалық элемент дегеніміз – химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады.Электролиттің ерітіндісі немесе балқымасы арқылы тұрақты ток өткенде электродтарда жүретін тотығу- тотықсыздану реакцияларын электролиз деп атайды. Электродтық потенциал дегеніміз —қос электрлі қабаттағы потенциалдар айырымын айтамыз.
32. Металдың химиялық белсенділігін сипаттайтын шама – стандартты электродтық потенциал деп атайды.
Нернст теңдеуі: φ= φ̊+RT/zF*ln c (Me^ z+)
33. Гальваникалық элемент.Гальваникалық элементтің электр қозғаушы күші.Гальваникалық элемент дегеніміз –химиялық энергияны электр энергиясына айналдыратын қондырғы.Гальваникалық элемент өз тұздарының ерітіндісіне батырылған екі электродтан тұрады. Гальваникалық элемент жұмыс істегенде электрод потенциалдарының ең максимальды айырмасы элементтің электр қозғаушы күші (Е) деп аталады.
34.Концентрациялық элемент деп әртүрлі концентрациялардағы тұздардың ерітінділеріне батырылған екі бірдей электродтан тұратын жүйені айтады.
35.Газ электродтары.Сутектік және оттектік электрод/ң потенциал/н есептеу. Сутек ê-дарының ст. потенциалы ол 298К темп-дағы сутек қысымы 1 атмосфера ж\е ерітіндідегі сутек иондарының белсенділігі бірге тең кездегі потенциалы.Иондану энергия/ң мәні үлкен болған/н асыл метал/р Au, Pt және т.б. ион/ры ерітін/ге беру арқылы потен-р айырма-н түзбейді.Ерітін/де бұл метал/ң иондарының болмауы асыл метал ерітінді шекарада пот-р айыр. түзілуіне маңызды қызметті мол-лар, атомдар және ортадағы иондарды іріктеп (таңдап) жұту арқылы жүргізіледі: станд. сутектік электрод дег-з сутегі иондары/ң (Н) активтік концен/сы (1 моль/л-ге) тең күкірт қ-лына батырылған беті электролитттік жолмен кеуек платинамен қапталған платина электроды.Платина пластинкасы (электроды) арқылы атмос-қ қысыммен сутегі газы жіберіледі, сутегі молекулалары кеуек платинада адсорбцияланады ж/е онда жақсы ериді.Плати/ң катализ/ры ретінде әсер етуінің нәтиж/де сут/і молек/ры аздап атомды/ға ыдыратады.
30Тотығу-тотығсыздану потенциалдары  мұндағы n-электрондар саны.F-Фарадей тұрақтысы. Электроттық потенциалдың пайда болу мәні:егер металл жолағын Me сол метал ионы бар ертіндіге енгізсе онда келесі құбылыс жүреді де
мұндағы n-электрондар саны.F-Фарадей тұрақтысы. Электроттық потенциалдың пайда болу мәні:егер металл жолағын Me сол метал ионы бар ертіндіге енгізсе онда келесі құбылыс жүреді де  металл мен ертінді арасында пот-р айырымы пайда болады,оны электродттық пот-р деп а.Бұл айырма металл табиғатына және ертіндідегі иондардың конц-сына,сол сиақты темп-ға тәуелді.Ст-ты жағдайда жүретін р-лар үшін,Гиббс эн-сы мен электодық пот-лы арасындағы байланыс
металл мен ертінді арасында пот-р айырымы пайда болады,оны электродттық пот-р деп а.Бұл айырма металл табиғатына және ертіндідегі иондардың конц-сына,сол сиақты темп-ға тәуелді.Ст-ты жағдайда жүретін р-лар үшін,Гиббс эн-сы мен электодық пот-лы арасындағы байланыс  теңд-мен өрнектеледі. Яғ. заттың тотыққан және тотықсызданған формалары бар ертіндіге инертті электрод батырылғанда пайда болатын потенциалды тотығу-тотықсыздану потенциалы деп атайды.Пот-лын есептейтін Нернст теңдеуі:
теңд-мен өрнектеледі. Яғ. заттың тотыққан және тотықсызданған формалары бар ертіндіге инертті электрод батырылғанда пайда болатын потенциалды тотығу-тотықсыздану потенциалы деп атайды.Пот-лын есептейтін Нернст теңдеуі:

- 31Э лектро/қ процес/ң/ң кинетикасы. Электрод потенциалы өзгереді-бұл құбылысыты поляризация д/ді. 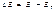
 поляр. Дейді.
поляр. Дейді.  тепе-теңдік потенциалы.Поляризация құбылысы анодта да, катодта да, байқалуы мүмкін, сонд/н поляризац/ны анодтыққа
тепе-теңдік потенциалы.Поляризация құбылысы анодта да, катодта да, байқалуы мүмкін, сонд/н поляризац/ны анодтыққа  ж/е потенциалдыққа
ж/е потенциалдыққа  бөледі.Сондай-ақ ток өткендегі потенциалдық өзгеруін аса кернеулік д/а.Ток тығыздығына потенциал/ң графикалық тәуелдігі поляризаци-қ қисық д/ді.
бөледі.Сондай-ақ ток өткендегі потенциалдық өзгеруін аса кернеулік д/а.Ток тығыздығына потенциал/ң графикалық тәуелдігі поляризаци-қ қисық д/ді.
 i-ток тығыздығы, S-электрод/қ беттік аудан алаңы.а)Электрохимиялық поляризация(аса кернеулік) ол реакциан/ң электрохимиялық кезеңі баяулауымен байланысты потенциал/ң өзгеруі мұны, яғни баяулатылған разряд теориасын ұсынған орыс ғалымы А.Н.Фрумкин.Электрохимиялық аса кернеулікпен
i-ток тығыздығы, S-электрод/қ беттік аудан алаңы.а)Электрохимиялық поляризация(аса кернеулік) ол реакциан/ң электрохимиялық кезеңі баяулауымен байланысты потенциал/ң өзгеруі мұны, яғни баяулатылған разряд теориасын ұсынған орыс ғалымы А.Н.Фрумкин.Электрохимиялық аса кернеулікпен  ж/е ток тығыздығы арасындағы байланысты Тафель теңдеуімен өрнектейді:
ж/е ток тығыздығы арасындағы байланысты Тафель теңдеуімен өрнектейді:  а,в-тұрақты б) концентрациалық поляризация-электрод айналасындағы қабатта ток өткенде байланысты электродтың потенциалының өзгеруі:
а,в-тұрақты б) концентрациалық поляризация-электрод айналасындағы қабатта ток өткенде байланысты электродтың потенциалының өзгеруі:  i-ток тығыздыға,
i-ток тығыздыға,  шекті ток
шекті ток  Ертінді көлеміндегі реагент/ң конц, D-диффузия коэфиценті.
Ертінді көлеміндегі реагент/ң конц, D-диффузия коэфиценті. 
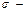 диффузия қабат қалыңдығы Сұйықтықты алмастырмаған кезде ондағы молекулалар тек қана диффузиның арқасында қозғалып, электрод бетінің жанында жұқа қабатты түзеді. Бұл жұқа қабат диффузиялық қабат д.а.
диффузия қабат қалыңдығы Сұйықтықты алмастырмаған кезде ондағы молекулалар тек қана диффузиның арқасында қозғалып, электрод бетінің жанында жұқа қабатты түзеді. Бұл жұқа қабат диффузиялық қабат д.а.
32 Электрод/ң ертіндісі н/е балқымасы арқылы тұрақты ток өткен кезде электродтарда жүретін тотығу-тотықсыздану реакциаларын электрлиз д.а. Тотықсыздану реакциасы жүретін электрод(катд) токтың сыртқы тізбегінің теріс полюсына, ал тотығу реакциасы жүретін электрод (анод)-оң полюсына қосылады.Натрий хлориді балқымасын электролиздегенде электродтарда өтетін реакциаларды қарастыр/қ.а) теріс заряд/н катодта натрий иондары металдық натрийге дейін тотықсызданады  б) оң зарядталған анодта хлорид-иондары газды хлорға дейін тотығады
б) оң зарядталған анодта хлорид-иондары газды хлорға дейін тотығады  Электролиз процесінің жалпы теңдеуі:
Электролиз процесінің жалпы теңдеуі:
Электролиз өзінен-өзі жүрмейтін реакция, өйткені электрлік ток түріндегі энергияны жұмсауды талап етеді.Электролит/ң сулы ертінді/ң электролизі күрделі сипатта өтеді, өйткені онда су диссоцияға ж/е электролизге түседі.Токтың қаншалықты пайдалы жұмсалғанын сандық мөлшер тұрғысынан сипаттау ток бойынша шығым д.а.
Ағылшын ғалымы М.Фарадей 1833 ж ұсынылған электролиз заңдары:1) электродтарда электрохим/қ түрленуге түскен заттың мөлшері: өткен электр тогының мөлшеріне тура пропорционал  Фарадей заңдарын біріктіру мынадай теңдеуге әкеледі:
Фарадей заңдарын біріктіру мынадай теңдеуге әкеледі:  F-Фарадей тұрақ/сы F-96500 2)электр тоғының мөлшері тұрақты болған кезде электродтағы әрекеттескен заттардың массасы бір-біріне олардың эквиваленттерінің молярлық массасы ретінде қатысады.Электрохимиялық процестер таза металл алуда,металды қабатпен қаптауда,қалдықтан тазартуда қолданылады.
F-Фарадей тұрақ/сы F-96500 2)электр тоғының мөлшері тұрақты болған кезде электродтағы әрекеттескен заттардың массасы бір-біріне олардың эквиваленттерінің молярлық массасы ретінде қатысады.Электрохимиялық процестер таза металл алуда,металды қабатпен қаптауда,қалдықтан тазартуда қолданылады.
33Қоршаған ортаның әсерінен металдың жаңа химиялық қосылыс түзе күйреуін – коррозия дейміз. Коррозияның күнде кездесетін мысалы- темірдің таттануы-темір ауадағы оттекпен тотығып, беті таттанады. Коррозия–металдарды қоршаушы ортаның әсерінен, өздігінен тотығу процесі. Коррозияның бір түрі – химиялық коррозия, ол қышқыл, сілті, тұздардың ерітінділерінің және түрлі газдардың (СО2, НСl т.б.) тікелей әрекеті. Электрохимиялық коррозия - ол болу үшін электрохимиялық процесс өту керек, ондай процесс үшін екі электрод және элекродттар батырылған электролиттер болуы керек. Металл таза болса коррозияға ұшырамайды. Көптеген металдардың бетін азот қышқылы тәрізді тотықтырғышпен өңдегенде коррозия күрт баяулайды. Мұндай металл бетіндеқорғаушы қабат түзіп тоттануды азайтатын заттарды ПАССИВАТОРЛАР(ингибаторлар) дейді. Керісінше тездететін заттрады АКТИВАТОРЛАР дейді. Коррозиямен күрес – металл бұйымдарын бояу, оксидирлеу(металл бетіне осы металлдың оксидінің тыығыз қабатын алу), анодтау, электролиз арқылы металлмен қаптау, ол катодтық (белсенділігі төмендеу металл қабығы) және анодтық (белсенділеу металл қабығы) болады., протекторлық қорғау, фосфаттандыру, Ингибаторларды қолдану, олар металл бетіне адсобцияланып оның потенциялын оңды етеді, осы арқылы жемірілу процесін баяулатады., электрмен қорғау
34. Коррозияның термодинамикасы мен кинетикасы. Химиялық коррозияның термодинамикасы Сұйық бейэлектролиттерде немесе жоғары температорада тотықтырғыш газдар(O2 галогиндер) ортада металдың өздігінен бүлінуінен химиялық коррозия жүреді. Коррозияда біден металдың электрондары тотықтырғышқа көшеді.Газдағы коррозияны қарастырайық.Металдың оттегімен тотығу реакция теңдеуін жазамыз nMe + m/2 * O2=MenOm..Бұл реакйия химиялық термодинамика заңы бойынша, жүйенің Гиббс энегиясының мәні азайса ғана жүреді (∆G<0) Ереже бойынша жай заттардың түзілуі Гиббс энергиясының мәні 0 ге тең болады.Металдардың тотығуы Гиббс энергиясының мәндері окситердің түзілуі Гиббс энергиясынң мәніне тең болады.Металдың тотығу реакциясының Гиббс энергиясын теңдеумен есептеуге болады. ∆G=∆G0-(mRT/2) LnPO2 Мұнда ∆G0- реакцияның стандарты Гиббс энергиясы; PO2- оттегінің салыстырмалы парциялдық қысымы (P=101.3); Көп металдырдың тотығу реакцияларының стандартты Гиббс энергиясының мәндері 0 ден кем болады.Сондықтан көп металдар оттегінің отмосфералық қысымында коррозияға ұшырайды. Термодинамика процесінің жүру мүмкіндігін көрсетеді, оның қандай жылдамдықпен жүруін айтпайды. Химиялық коррозияның кинетикасы химиялық коррозияның жылдамдығына көп факторлар әсер етеді.Қабыршақ бетінің тутастығы,қорғау қасйеттерімен және оны сызаттармен тотығу жылдамдығы анықталады. Коррозия өнімдерінің қабыршағы сынғыш және сызымдылығы аз. Қабыршақта сызықтың пайда болуы коррозия өнімлерінің металдырмен метал көлемдерінің арақатынасына байланысты. Vок/Vме=Mdme/(ndмеA), Мұнда Vок- окситің көлемі; Vме- металдың көлемі; M- окситтің молярлық массасы; dme- металдың тығыздығы; n- окситтің молекуласындағы металдың атом саны; A- Металдың атомдық массасы.Егер Vок/Vме<1 корозиядан қорғамайды.Қабыршақтың өсу жылдамдығы уақытқа тәуелді.Егер Vок/Vме>1 түзілген қабыршақ тұтас металды коррозиядан қорғайды.
35Металдардың физика-химиялық қасиеттері. Металдарды алудың негізгі әдістері Металдардың жалпы қасиеттеріне кристалл торларының ерекше құрылысы себепші болады. Металдардың барлығына тән қасиет - металдық жылтыр. Металдар сондай- ақ радиотолқынын да шағылыстыра алады. Металдар- электр мен жылуды жақсы өткізгіштер.Металдардың электрөткізгіштігі мен жылу өткізгіштігі Hg–нан Ag-ға қарай артады:Hg,Pb,Fe,Zn,Mg.Al,Au,Cu,AgМыс пен алюминий электрді жақсы өткізетін металдар болғандықтан, оларды электрөткізгіштер ретінде пайдаланады.Металдар атомдарының химиялық реакция кезінде валенттік электрондар беріп, оң зарядты ионға айналуы олардың ең жалпы химиялық қасиеті болып табылады, яғни металдар реакция кезінде тотықсыздандырғыш болып келеді. Металдр электртерістігі күшті галогендермен, оттегімен, күкіртпен қуаттырақ әрекеттеседі. Бұл реакцияларда сәйкес келетін бейметалдар тотықтырғыш болып табылады. Металдар, сондай- ақ сутегі иондарымен де, басқа металдар иондарымен де тотыға алады.Li, K, Ca, Na, Al, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Ag, Pt, Au
Бұл қатар металдар кернеуінің электрохимиялық қатары деп аталады. Мұндай қатардағы ең актив элемент литий екен.Кернеудің электрохимиялық қатарындағы солға қарай тұрған металл оңға қарай орналасқан металл тұзының ерітіндіснен немесе балқымасынан металды ығыстырып шығара алады.Кернеудің электрохимиялық қатарына сондай -ақ сутегі де енеді. Бұл металдардың қайсысы қышқыл ерітіндісінің сутегіні ығыстыра алатынына қорытындыжасауға мүмкіндік береді. Металдады алу әдістеріАктивтігі жоғары металдар (Na,K, Ca, Mg) электролиз әдісімен алынады. Активігі аз металдарды оладың оксидінен көмірмен, көміртегі оксидімен неме алюминий оксидімен тотықсыздандырады, ал металл сульфидтерін алдымен өртейді.
Не нашли, что искали? Воспользуйтесь поиском: