
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Слабые электролиты. Константа диссоциации
Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:
АаВb ↔ аАx- + bВ y+

Для бинарного электролита:

Для разбавленных растворов можно считать, что (1 – α) = 1 и К ≈ α2С.

– закон разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Активность растворенного вещества – эмпирическая величина, заменяющая концентрацию, – активность (эффективная концентрация) а, связанная с концентрацией через коэффициент активности f, который является мерой отклонения свойств реального раствора от идеального:
а = fC; а+ = f +С+; а_ = f_C_.
Для бинарного электролита:
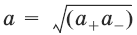
– средняя активность электролита;

– средний коэффициент активности.
Предельный закон Дебая-Хюккеля для бинарного электролита: lg f = -0,51z 2I ½, где z – заряд иона, для которого рассчитывается коэффициент активности;
I – ионная сила раствора I = 0,5Σ(Сiri2).
Не нашли, что искали? Воспользуйтесь поиском: