
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Валентность. Степень окисления.
Валентность – способность атома в соединении образовывать определенное число химических связей с атомом другого элемента. В образовании химической связи участвуют валентные электроны (электроны внешнего энергетического уровня), прежде всего – неспаренные электроны, но и спаренные тоже могут. В возбужденном состоянии электроны могут переходить на внешний уровень. Высшая валентность совпадает с номером группы, а низшая равна 8-N группы, т.о. для S высшая равна 6, низшая – 8-6=2 (в основном состоянии):
Валентность II





 S P d
S P d
Уже валентность IV
S P d
 
| 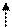
| 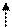
| 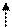
| 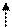
|
Уже валентность VI
3s1 3p3 3d2

| 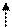
| 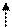
| 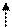
| 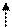
| 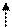
|
Валентность не имеет знака и обозначается римскими цифрами.
 Щелочные металлы первой группы главной подгруппы - постоянная валентность всегда I, и у F, (т.к. не хватает 1 электрона на внешнем уровне и нет свободных подуровней). Также постоянная валентность I у серебра и водорода.Щелочноземельные металлы – II группа главная подгруппа – валентность всегда II; и у цинка и кислорода. Алюминий и бор – постоянная валентность – III.
Щелочные металлы первой группы главной подгруппы - постоянная валентность всегда I, и у F, (т.к. не хватает 1 электрона на внешнем уровне и нет свободных подуровней). Также постоянная валентность I у серебра и водорода.Щелочноземельные металлы – II группа главная подгруппа – валентность всегда II; и у цинка и кислорода. Алюминий и бор – постоянная валентность – III.
Переменная валентность, например: Cu (I и II), Cr, Fe (II, III, VI), S (II, IV, VI) и др.
Низшая валентность с V по VII группы находится по формуле 8-Nгруппы, исключение – N, его высшая валентность IV - NH4
Степень окисления – понятие формальное, обозначающее заряд атома в молекуле вещества. (способность того или иного атома образовывать ионную связь характеризуют понятием степени окисления элемента.) При определении СО следует иметь ввиду, что суммарная СО всех атомов в молекуле =0
Для определения СО атомов в химических соединениях используют следующие допущения:
I) степень окисления кислорода в соединениях обычно равна -2 (кроме ОF2 (т.к. СО F всегда -1, то здесь у O будет +2), Н2О2 (т.к. у Н всегда +1, то здесь у О -1)
II) степень окисления водорода равна +1 в соединениях с неметаллами и -1 в соединениях с металлами (КН, СаН2).
III) Постоянную СО = +1 имеют щелочные металлы (главная подгруппа 1-й группы)
IV) Постоянную СО = +2 имеют щелочно-земельные металлы (главная подгруппа 2-й группы), также цинк и кадмий.
V) СО атомов в простых веществах =0 (Cl2,H2, O2)
VI) У F постоянная СО = -1
При определении СО условно предполагают, что в соединении валентные электроны переходят к более электроотрицательным атомам, => соединения эти состоят только из «+» и «-«заряженных ионов. В действительности же, в большинстве случаев происходит не полная отдача электронов, а только смещение электронной пары от одного атома к другому.
Не нашли, что искали? Воспользуйтесь поиском: