
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электролиз расплавов и растворов.
Электролиз – ОВ процесс, протекающий на электродах при прохождении постоянного эл-го тока через расплав или раствор электролита. Э проводят в специальных устройствах – электролизерах или электролитических ваннах
 В р-р или расплав электролита погружают 2 токопроводящих электрода, которые соединены с источником эл-го тока, под действием которого на одном из электродов образуется избыток электронов (отрицательный электрод), на другом – недостаток электронов (положительный электрод). В эл-м поле ионы, имеющиеся в р-ре или расплаве в результате диссоциации электролита, приобретают направленное движение – катионы – к «-«электроду, анионы – к «+».
В р-р или расплав электролита погружают 2 токопроводящих электрода, которые соединены с источником эл-го тока, под действием которого на одном из электродов образуется избыток электронов (отрицательный электрод), на другом – недостаток электронов (положительный электрод). В эл-м поле ионы, имеющиеся в р-ре или расплаве в результате диссоциации электролита, приобретают направленное движение – катионы – к «-«электроду, анионы – к «+».
Частицы из р-ра или расплава (ионы, молекулы), находящиеся вблизи «-«эл-да принимают электроны, т.е. восстанавливаются, электрод, на котором происходит восстановление – катод.
Частицы, находящиеся вблизи «+» эл-да отдают электроны, т.е. окисляются, электрод, на котором происходит окисление – анод. Электродами для Э м служить различные электропроводящие материалы. В ходе Э электроды м оставаться без изменения, т.е. не окисляться под действием эл тока. Такие эл-ды называются инертными (нерастворимыми). В качестве материалов для инертных анодов обычно используют платину или графит.
Существуют окисляемые (растворимые) аноды (медные и никелевые). Эл-ды обоих типов применяются на практике.
I) Э расплавов с инертным анодом. При Э расплаленной соли или щелочи с инертным анодом на катоде всегда восстанавливаются катионы металла, на инертном аноде – окисляются анионы кислотного остатка (Э расплавов солей) или гидроксид анионы (Э расплавов щелочей)
 KCl K+ + Cl-
KCl K+ + Cl-
 (K): K+ + e- K | | 2
(K): K+ + e- K | | 2
| 2 |
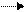 (A): 2Cl- - 2e- Cl2 | | 1
(A): 2Cl- - 2e- Cl2 | | 1
 2K+ + 2Cl- эл-з 2К + Cl2
2K+ + 2Cl- эл-з 2К + Cl2
 2 KCl эл-з 2К + Cl2
2 KCl эл-з 2К + Cl2
II) Э р-ров с инертным анодом. При Э водных р-ров электролитов на электродах наряду с разряжением катионов и анионов или вместо них м восстанавливаться или окисляться молекулы воды. Чтобы определить, какие частицы участвуют в катодном процессе, пользуются рядом стандартных электродных потенциалов (Е о, измеряется в вольтах)
Возможны 3 варианта протекания Э: о
1) если в р-ре содержатся потенциал определяющие ионы электродов с Е < -1.18 В (К+, Са 2+.._), то они не будут восстанавливаться в одном р-ре, т.к. легче них восстановятся молекулы воды:
 (К): 2Н2О + 2е- Н2 + 2ОН-
(К): 2Н2О + 2е- Н2 + 2ОН-
о
2) если в р-ре содержатся ионы Н+, Сu+, Ag+ и др со значением Е > 0, то они легко восстановятся: 2+
 (К): Сu + 2e- Cu о
(К): Сu + 2e- Cu о
3) в р-ре, содержащем потенциал определяющие ионы электродов с 0 > Е > -1.18 В, то идут параллельно 2 процесса:
2+
 (К): Сd + 2 е- Сd
(К): Сd + 2 е- Сd
-
 (К): 2Н2О + 2е- Н2 + 2ОН
(К): 2Н2О + 2е- Н2 + 2ОН
Большая1
часть эл-ва затрачивается на металл в анодном процессе: если в р-ре присутствуют анионы F-, SO4 2-, NO3 - PO4 3-, CO3 2- и др, то окислению подвергается только вода
 (+): 2Н2О - 4 е- 4 Н+ + О2
(+): 2Н2О - 4 е- 4 Н+ + О2
Если анионы безкислородных кислот кроме фторидов и ОН- (гидроксиды) - то они подвергаются окислению.
 (+): 2J- - 2e- J2
(+): 2J- - 2e- J2

 (+): 4OH- - 4e- 2Н2О + О2
(+): 4OH- - 4e- 2Н2О + О2
III) Э с растворимым анодом. В качестве растворимых анодов используют медь, никель, собальт, кадмий, олово. На аноде – окисление этого электрода (Ме), а процесс на катоде
протекает также, как и при Э р-ров с инертным анодом o 2+
Пример: водный р-р CdSO4 с кадмиевыми электродами Cd: E (Cd / Cd) = -0.4 B =>
2+ 2+
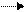
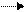 (K): Cd + 2e- Cd (A): Cd - 2e- Cd
(K): Cd + 2e- Cd (A): Cd - 2e- Cd
 (K): 2Н2О + 2е- Н2 + 2ОН-
(K): 2Н2О + 2е- Н2 + 2ОН-
Суммарную р-ю в этом случае записать нельзя, т.к. неизвестно, какая часть из обющего количества электричества затрачивается на восстановление воды, а какая – на разряд ионов кадмия.
Не нашли, что искали? Воспользуйтесь поиском: